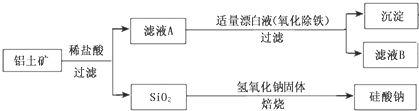
题目内容
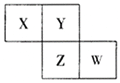
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )
A. 氧化物对应水化物酸性W比Z强
B. Y单质与Z的氢化物水溶液反应,有沉淀生成
C. X单质在室温下为固体
D. 简单离子的半径:Z<W
【答案】B
【解析】
X、Y、Z、W均为短周期元素,W原子的最外层电子数比内层电子数少3个,则W的最外层电子数为7,为第三周期的Cl元素,结合元素在周期表中相对位置可以知道,Z为S,Y为O,X为N,以此来解答。
由上述分析可以知道,X为N,Y为O,Z为S,W为Cl,
A.非金属性Cl>S,最高价氧化物对应水化物酸性W比Z强,题中没有说明为最高价,则不能确定酸性强弱,故A错误;
B.氧气和硫化氢反应生成硫,溶液变浑浊,所以B选项是正确的;
C. X为N,X单质N2在室温下为气体,故C错误;
D.Z、W的简单离子具有相同的核外电子排布,核电荷数越大离子半径越小,故D错误。
所以B选项是正确的。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
【题目】下列各组物质中,存在X→Y或Y→Z不能通过一步反应完成转化的一组是
选项 | X | Y | Z |
A | Al | NaAlO2(aq) | Al(OH)3 |
B | MgO | MgCl2(aq) | Mg |
C | H2O(g) | Fe3O4 | Fe |
D | NaOH(aq) | Na2CO3(aq) | NaHCO3(aq) |
A. A B. B C. C D. D