题目内容
CuSO![]() 在一定条件下发生如下分解CuSO
在一定条件下发生如下分解CuSO![]()
![]() CuO+SO
CuO+SO![]() +SO
+SO![]() +O
+O![]() ,有人设计通过实验测定反应产生的SO2、SO3、O2的物质的量的方法,并经设计确定该化学方程式中各物质的系数,实验测得的数据及有关结果如下:
,有人设计通过实验测定反应产生的SO2、SO3、O2的物质的量的方法,并经设计确定该化学方程式中各物质的系数,实验测得的数据及有关结果如下:
①准确称量无水硫酸铜6.0 g
②测出量筒中水的体积后,折算成排水之气体在标准状况下的气体为280 mL
③干燥管质量在实验结束时增加2.4 g
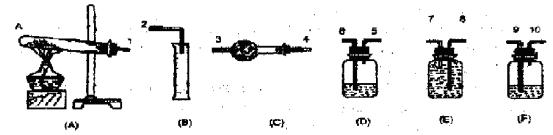
④实验结束。装置F中的溶液变为NaHSO4溶液(不含其它杂质)所用仪器装置如下:
请回答:
(1)按装置从左到右的方向,各仪器的接口连接顺序为
(2)装置F的作用
(3)装置D的作用
(4)首先应计算的物质是 ,通过计算得到的化学方程式是
。
解析:
(1)①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→② (2)吸收SO3放出等物质的量的SO2 (3)干燥SO2和O2 (4)O2;
3CuSO4
|
提示:
(1)A装置应是CuSO4加热分解的装置。 (2)实验是根据测出量筒中水的体积后,推算出排水之气体在标准状况下的体积。CuSO4加热后产生SO2、SO3、O2三种气体,只有O2是难溶于水的,所以280 mL的气体肯定是O2。 (3)实验结束时,装置F中的溶液由饱和的NaHSO3变为NaHSO4,显然是有SO3气体通过F,发生了如下反应:NaHSO3+SO3=NaHSO4+SO2 (4)D装置中的浓硫酸是用来干燥SO2和O2。 (5)干燥管在实验结束时增加2.4 g,应是碱石灰吸收的SO2的质量。其中包括CuSO4加热分解生成的SO2与SO3和NaHSO3溶液反应生成的SO2。 (6)综上所述进行计算: n(CuSO4)=6.0 g/160 g•mol-1=0.0375(mol) n(O2)=280 mL/22400 mL•mol-1=0.0125(mol) n(SO2)=2.4 g/64 g•mol-1=0.0375(mol) 则有n(CuSO4)∶n(SO2)∶n(O2)=3∶3∶1 根据n(CuSO4)∶n(O2)=3∶1,每生成1 mol O2,则有4 mol电子转移,所以3 mol CuSO4加热分解能生成2 mol SO2、1 mol SO3和1 mol O2。
|

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案