题目内容
4.科学研究表明,月球上有丰富的${\;}_{2}^{3}$He资源,可开发利用作未来的新型能源.(1)${\;}_{2}^{3}$He的中子数是1,${\;}_{2}^{3}$He与${\;}_{2}^{4}$He与互称为同位素.
(2)在${\;}_{2}^{3}$He与${\;}_{2}^{4}$He两种核素中,原子核内的中子数之差为1,质子数之差是0.
分析 (1)中子数=质量数-质子数,具有相同质子数、不同中子数的原子互为同位素;
(2)中子数=质量数-质子数;元素符号的左下角是质子数.
解答 解:(1)中子数=质量数-质子数=3-2=1;${\;}_{2}^{3}$He与${\;}_{2}^{4}$He具有相同质子数、不同中子数,互为同位素,故答案为:1;同位素;
(2)中子数=质量数-质子数,在${\;}_{2}^{3}$He与${\;}_{2}^{4}$He两种核素中,原子核内的中子数分别为1、2,2-1=1,质子数之差是2-2=0,故答案为:1;0.
点评 本题考查原子构成,注意原子由原子核和核外电子构成,其中原子核由质子和中子构成的;熟记规律“原子序数=核内质子数=核外电子数=核电荷数”是解题的关键,题目难度不大.

练习册系列答案
相关题目
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 60.0g水晶晶体中,含有“Si-O”键的数目为NA | |
| B. | 7.8 g过氧化钠晶体中含有阴离子的数目为0.2NA | |
| C. | 18.4 g甲苯中含有碳碳双键的个数为0.6 NA | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
12.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 单质氧化性:X>Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
19.当前在人类已知的化合物中,品种最多的是( )
| A. | ⅤA 族元素的化合物 | B. | ⅢB族元素的化合物 | ||
| C. | 过渡元素的化合物 | D. | ⅣA 族元素的化合物 |
9.下列说法中错误的是( )
| A. | 质量数相同的不同原子,其化学性质一定相同 | |
| B. | 质子数相同的原子,其核外电子排布也相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
16.在下列有关晶体的叙述中错误的是( )
| A. | 离子晶体中,一定不存在共价键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 金属晶体的熔沸点均很高 | D. | 稀有气体的原子能形成分子晶体 |
14.AlCl3易溶于四氯化碳,加热到180℃升华.推测三氯化铝有可能属于( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
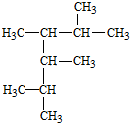 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷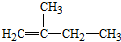 2-甲基-1-丁烯
2-甲基-1-丁烯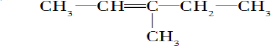 .
. .
.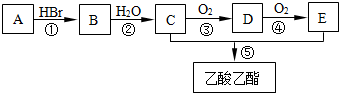
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.