题目内容
在t℃向一密闭容器中放入1mol A 和1 mol B发生反应:A(固) + B(气) C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
| A.2molA和1molB | B.2molD和1mol A 和 1molB |
| C.1molC和2molD 和1molB | D.1molC和1molD |
A
解析试题分析:所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。等效平衡一般有三种类型:I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△n≠0的体系):等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同。II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△n=0的体系):等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。III类:恒温恒压下对于气体体系等效转化后,要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。由于反应物A是固体,所以改变固体的质量不会影响平衡状态,A正确;B中B中开始有生成物D存在,不正确;C中相对于是2molB,不正确;D中换算后,仍然存在生成物,不正确,答案选A。
考点:考查等效平衡的有关判断
点评:该题是中等难度的试题,对学生的要求较高,不易得分。解答该类型试题的关键是分清等效平衡的类别,用相应的方法求解即可

(14分)向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。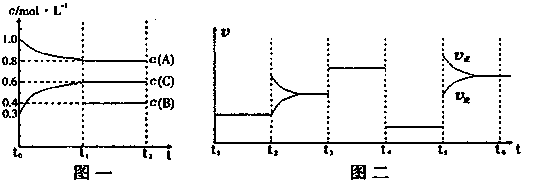
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
| t1—t2 | t2—t3 | t3—t4 | t4—t5 | t5—t6 |
| K1 | K2 | K3 | K4 | K5 |
K1 K2 K3 K4 K5 (用“>”、“<”或“=”连接)
(3)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。
(含a,b,c的代数式表示)
(14分)向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
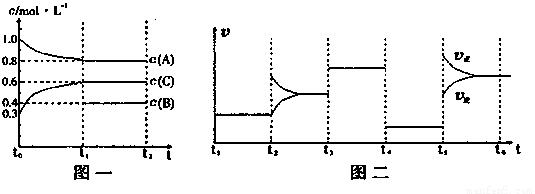
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
|
t1—t2 |
t2—t3 |
t3—t4 |
t4—t5 |
t5—t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1 K2 K3 K4 K5 (用“>”、“<”或“=”连接)
(3)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。
(含a,b,c的代数式表示)
 已知可逆反应:FeO(s)+CO(g)
已知可逆反应:FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度T与n(CO2)/n(CO)的比值关系如右下表所示.下列有关说法正确的是( )
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度T与n(CO2)/n(CO)的比值关系如右下表所示.下列有关说法正确的是( ) C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是