题目内容
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 H2SO4溶液
(1)若配制250 mL H2SO4溶液,则需量筒量取密度为1.84 g·cm-3,质量分数为98%的浓硫酸____mL。
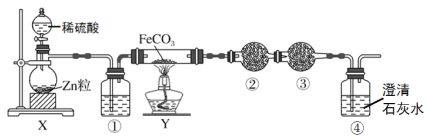
Ⅱ.测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:
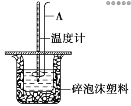
(2)仪器A的名称为___________。
(3)写出表示该反应中和热的热化学方程式:__________________。
(4)取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。
实验 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差的平均值为____
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=___________(取小数点后一位)。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)碎泡沫塑料的作用是___________。
【答案】6.8 环形玻璃搅拌棒 ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l) △H=-57.3 kJmol-1。 4.0 -53.5kJmol-1 ad 保温、隔热,减少实验过程中热量损失
Na2SO4(aq)+H2O(l) △H=-57.3 kJmol-1。 4.0 -53.5kJmol-1 ad 保温、隔热,减少实验过程中热量损失
【解析】
(1)由溶液稀释前后,溶质质量不变可得:1.84g/cm3×V×98%=0.5mol/L×0.25L×98g/mol,解得V=6.8mL;答案为6.8;
(2)由图可以看出仪器A为环形玻璃搅拌棒;答案为环形玻璃搅拌棒;
(3)强酸强碱的中和热为-57.3kJ/mol,中和热是强酸和强碱的稀溶液完全反应生成1mol液态水放出的热量,稀硫酸和稀氢氧化钠溶液反应的热化学方程式为![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3 kJmol-1;答案为
Na2SO4(aq)+H2O(l)△H=-57.3 kJmol-1;答案为![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3 kJmol-1;
Na2SO4(aq)+H2O(l)△H=-57.3 kJmol-1;
(4)①温度差分别为2.5℃、4.0℃、3.9℃、4.1℃,第一次实验温度差误差较大,应舍弃,故温度差平均值为(4.0℃+3.9℃+4.0℃)/3=4.0℃;答案为4.0℃;
②生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为80mL×1g/cm3=80g,温度差为4℃,则生成0.025mol的水应放出的热量为Q=mc△t=80g×4.18J·(g·℃)-1×4℃=1337.6J=1.3376kJ,所以实验测得的中和热△H=![]() =-53.5kJmol-1;答案为-53.5kJmol-1;
=-53.5kJmol-1;答案为-53.5kJmol-1;
③a项实验装置保温、隔热效果差,求得放出的热量偏小,中和热的数值偏小;
b项量取氢氧化钠溶液的体积时仰视读数,会导致所量取的氢氧化钠溶液体积偏大,放出热量偏高,中和热的数值偏大;
c项为正确操作,不会引起误差;
d项温度计测定氢氧化钠溶液起始温度,直接插入硫酸溶液测温度,导致硫酸溶液的起始温度偏高,求得的放出热量偏小,中和热数值偏小;据此分析只有ad选项才能使得中和热的数据偏小;
答案为ad;
(5)碎泡沫塑料的导热效果差,可以起到保温、隔热,减少实验过程中热量损失等作用;答案为保温、隔热,减少实验过程中热量损失。

 考前必练系列答案
考前必练系列答案【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
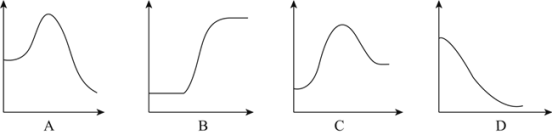
(1)N2分子通常条件下非常稳定,其本质原因是_____,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________、_________________。
【题目】某小组对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.出现浑浊,溶液变为黄绿色; ⅱ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是_________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是______________________。
(3)甲同学认为现象i中溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是___________________。
(4)乙同学通过实验确定了A瓶中大量白色沉淀是CaSO4,并用离子方程式解释了现象ⅱ中黄绿色褪去的原因是________。