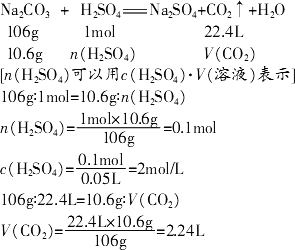题目内容
向10.6 g碳酸钠固体中加入一定浓度的硫酸溶液,当二者恰好完全反应时,消耗硫酸溶液的体积是50 mL.计算原硫酸溶液中溶质的物质的量浓度及反应生成的二氧化碳气体的体积(标准状况).
答案:
解析:
解析:
|
答:原硫酸溶液中溶质的物质的量浓度是2 mol/L,反应产生的二氧化碳气体在标准状况下的体积是2.24 L. 讲析:写出反应的化学方程式(或离子方程式),将已知、待求的物理量标于对应物质的正下方(注意:同一种物质必须用相同的物理量表示). 点评:在进行化学方程式的计算时,首先应该明确反应的实质,写出与题目有关的化学方程式或离子方程式,然后结合题目,找出其中的已知量和未知量(如果已知量和未知量不在同一个反应中,要找出联系它们的纽带),最后进行正确的计算.规范步骤在此时显得尤为重要. |

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
|
在一定温度下碳酸钠的溶解度为40 g,向280 g的饱和碳酸钠溶液中加入10.6 g无水碳酸钠,搅拌静置,最终所得晶体的质量为 | |
A. |
10.6 g |
B. |
60.6 g |
C. |
2.86 g |
D. |
89.2 g |