题目内容
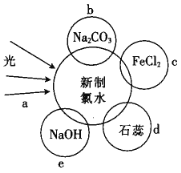
【题目】氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d、e中重合部分代表物质间反应,且氯水足量)。
(1)氯水中含有的粒子有![]() 、
、![]() 、______、
、______、![]() 、
、![]() 、______、
、______、![]() 七种。
七种。
(2)久置的氯水变为_____________,原因是___________________________(用化学反应方程式表示)。
(3)b过程中的离子方程式是_______________________。
(4)e过程中所发生的主要反应的化学方程式为____________________________。
(5)能证明氯水具有漂白性的是______________________(填“a”“b”“c”或“d”)。
【答案】![]()
![]() 稀
稀![]()
![]() ↑
↑ ![]() ↑
↑ ![]() (或
(或![]() 或
或![]() ,任写一个都可以) d
,任写一个都可以) d
【解析】
氯气溶于水形成的溶液为氯水,新制氯水中含有三分子:![]() 、
、![]() ,
,![]() ,含有四种离子:
,含有四种离子:![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)氯气溶于水,一部分氯气与水反应:![]() ,所以氯水中含有的粒子有
,所以氯水中含有的粒子有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)由于在光照条件下,![]() 可分解:
可分解:![]() ↑,所以久置的氯水变为稀
↑,所以久置的氯水变为稀![]() ,故答案为:稀
,故答案为:稀![]() ;
;![]() ↑;
↑;
(3)b过程中碳酸钠溶液中的![]() 与氯水中的
与氯水中的![]() 反应,其离子反应方程式:
反应,其离子反应方程式:![]() ↑;故答案为:
↑;故答案为:![]() ↑;
↑;
(4)e过程中氢氧化钠分别与氯水中的![]() 、
、![]() 、
、![]() 反应,其化学反应方程式为:
反应,其化学反应方程式为:![]() (或
(或![]() 或
或![]() ,任写一个都可以),故答案为:
,任写一个都可以),故答案为: ![]() (或
(或![]() 或
或![]() ,任写一个都可以);
,任写一个都可以);
(5)氯气能使湿润的蓝色石蕊试纸先变红,后褪色,能证明氯水具有漂白性可以选d,故答案为:d。

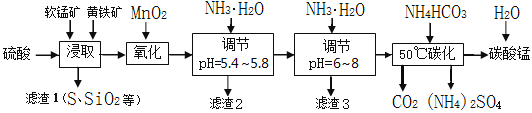
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。