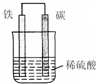
题目内容
在25℃,101kPa条件下,将15L O2通入10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
(1)若剩余气体的体积是15L,则原CO和H2的混合气中V(CO)=______ L,V(H2)=______ L.
(2)若剩余气体的体积为a L,则原CO和H2的混合气中V(CO):V(H2)=______.
(3)若剩余气体的体积为aL,则a的取值范围是______.
由2CO+O2
 2CO2,△V
2CO2,△V2 1 2 1
x
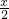
2H2+O2
 2H2O,△V
2H2O,△V2 1 3
(10-x)

则
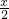 +
+ =15+10-15,
=15+10-15,解得x=5,即V(CO)为5L,则V(H2)为(10-x)L=5L,
故答案为:5;5;
(2)由(1)可得:
则
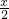 +
+ =15+10-a,
=15+10-a,解得x=(a-10)L,V(H2)为(10-x)L=(20-a)L,
即 V(CO):V(H2)=(a-10):(20-a)
故答案为:(a-10):(20-a);
(3)由(2)可知:
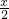 +
+ =15+10-a,
=15+10-a,a=10+x,
因0<x<10,
则10<a<20,
故答案为:10<a<20.
分析:(1)先设出气体的体积,利用方程式及剩余的气体的体积及体积之差来计算混合物中气体的体积;
(2)根据气体的剩余气体的体积及反应前后气体的体积差来计算;
(3)对于混合气体采用极限法来分析剩余气体的体积.
点评:本题考查学生差量法和极限法来计算,明确反应前后体积的变化及该条件下水的状态是解答的关键,学生容易忽略水在常温下为液体而导致分析错误.

X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
|
Y |
Y是地壳中含量最高的元素 |
|
Z |
Z的基态原子最外层电子排布式为3s23p1 |
|
W |
W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示, 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)

2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=______.
(2)请说明以CO2为原料合成乙醇的优点是______(只要求写出一条).
(3)在一定压强下,测得该反应的实验数据如下表:
| 温度/℃CO2转化率/% n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
②一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______;平衡常数K______.(填“增大”、“减小”、或“不变”)
(4)在下图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含义作必要的标注.

(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳.该电池的负极反应式为:
______.
(6)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和1366.8kJ?mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式______.