题目内容
【题目】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
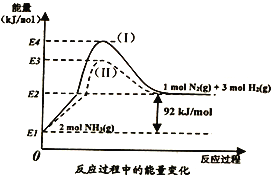
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为__________________________。
②过程(I)和过程(Ⅱ)的反应热__________(填“相同”或“不同”),原因是_______________。
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g)![]() 2NH3(g)的平衡常数为__________,H2的平衡转化率为__________________________。
2NH3(g)的平衡常数为__________,H2的平衡转化率为__________________________。
(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol
反应Ⅱ:N2(g)+O2(g)![]() 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol
反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol
则:反应Ⅱ中的b=______ kJ/mol(用含a、c的代数式表示),反应Ⅲ中的△S________0(填“>”“<”或“=”)。
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:

①分析得P1_________P2 (填“>”“<”或“=”)。
②下列叙述中,不能判断反应Ⅲ己经达到平衡状态的标志是__________(填序号)。
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
【答案】 N2(g)+3H2(g)![]() 2NH3(g) △H= -92 kJ/mol 相同 反应热只与反应体系的始态和终态有关,而与反应的途径无关
2NH3(g) △H= -92 kJ/mol 相同 反应热只与反应体系的始态和终态有关,而与反应的途径无关 ![]() (L·mol)2 60%
(L·mol)2 60% ![]() > < bd
> < bd
【解析】(1)①由能量转化关系图可知N2(g)与H2(g)反应生成NH3(g)的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H= -92 kJ/mol;
2NH3(g) △H= -92 kJ/mol;
②有盖斯定律可知,反应热只与反应体系的始态和终态有关,而与反应的途径无关,则过程(I)和过程(Ⅱ)的反应热相同;
③ N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L) 1 3 0
起始浓度(mol/L) c 3c 2c
起始浓度(mol/L) 1-c 3-3c 2c
达到平衡时,混合气体的总量为2.8mol,(1-c+3-3c+2c)mol/L×1L=2.8mol,解得:c=0.6mol/L,此温度下平衡常数K=![]() =
=![]() (L·mol)2;H2的平衡转化率为
(L·mol)2;H2的平衡转化率为![]() ×100%=60%;
×100%=60%;
(2)已知:反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1= a kJ/mol,反应Ⅲ:4NH3(g)+6NO(g)
2N2(g)+6H2O(g) △H1= a kJ/mol,反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H3= c kJ/mol,则盖斯定律可知,(I-Ⅲ)×
5N2(g)+6H2O(g) △H3= c kJ/mol,则盖斯定律可知,(I-Ⅲ)×![]() 得N2(g)+O2(g)
得N2(g)+O2(g)![]() 2NO(g),则△H2=b kJ/mol=
2NO(g),则△H2=b kJ/mol=![]() kJ/mol;反应Ⅲ4NH3(g)+6NO(g)
kJ/mol;反应Ⅲ4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) 是气体体积增大的反应,反应的熵变△S>0;
5N2(g)+6H2O(g) 是气体体积增大的反应,反应的熵变△S>0;
(3)①在恒温下,增大压强平衡逆向移动,反应物的转化率降低,则由图示可知P1>P2;
②a. N2的浓度不再改变,说明反应处于平衡状态,故a正确;b.断裂6molN-H键的同时,有6molH-O键形成,均为正反应速率,无法判断是否是平衡状态,故b错误;C.反应过程中气体总物质的量始终变化,当容器中压强不再变化时,说明气体总物质的量一定,此时是平衡状态,故c正确;d.混合气体的质量和体积始终不变,则混合气体的密度保持不变,无法判断是平衡状态,故d错误;答案为bd。







