题目内容
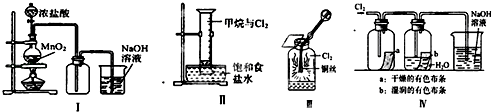
【题目】某研究性学习小组学生用图中所示装置(部分夹持装置略)探究NO与Na2O2反应的情况,提出假设并进行相关实验。

该研究性学习小组同学认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO4-反应生成NO3-和Mn2+。
(1)在反应前,打开弹簧夹,通入一段时间N2,目的是__________________________。
(2)A 中反应的氧化剂与还原剂的物质的量之比为______________。
(3)B 中观察到的主要现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生
(4)C、E 中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
(5)F 中反应的离子方程式是_________________________________________。
(6)充分反应后,检验D装置中产物的方法是: _____________________________ ,则产物是NaNO2。
【答案】 将装置中的空气排出 2:1 a c a 5NO+3MnO4-+4 H+==5NO3-+3Mn2++2 H2O 取D装置中产物少许,加入稀盐酸,产生红棕色气体
【解析】(1)空气中的氧气能氧化NO,实验时要排尽装置中的空气,所以在反应前,打开弹簧夹,通入一段时间N2,目的:将装置中的空气排出;(2)A 中铜与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O中的氧化剂HNO3与还原剂Cu的物质的量之比为2:1;(3)在B装置中二氧化氮与水反应生成稀硝酸,稀硝酸与Cu反应生成NO,所以B中观察到的主要现象是:铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,答案选a c;(4)无水硫酸铜只能检验水不能吸收水,故选a;(5)F中为吸收一氧化氮的反应,高锰酸根离子被还原生成二价锰离子降低5价,还原剂为NO被氧化成硝酸根离子升高3价,则根据得失电子守恒及质量守恒原则配平得反应离子方程式为5NO+3MnO4-+4 H+==5NO3-+3Mn2++2 H2O;(6)亚硝酸钠中加盐酸会生成NO,NO遇到空气中的氧气会变为红棕色,则检验D装置中物质的方法为:取D装置中产物少许,加入稀盐酸,若产生无色气体,遇到空气变为红棕色,产物是亚硝酸钠。

【题目】根据所学知识,完成下面题目:
(1)亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应获得:NO(g)+Cl2(g)═2ClNO(g).①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)2ClNO(g)△H3 K3
则△H3=(用△H1和△H2表示),K3=(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10﹣4 ,
那么室温下NO2﹣的水解常数Kh= , 0.1mol/L NaNO2溶液中从c(Na+ )、c(OH﹣ )、c(NO2﹣ )、c(HNO2)的大小顺序为 .
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20molNO2 , 在一定温度下进行反应,CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
①由表中数据计算0~4min内v(NO2)= , 该温度下的平衡常数K=(不必带单位).
②在一恒容装置中,通入一定量CH4和NO2 , 测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):
则下列叙述正确的是 .
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)