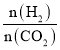题目内容
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为___。
(2)反应开始至2min,气体Z的平均反应速率为___。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的___倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ___(填”增大”“减小”或”相等”)。
③若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___反应(填“放热”或“吸热”)。
(4)在一密闭容器中发生反应N2(g)+3H2(g) ![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
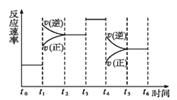
①处于平衡状态的时间段是___(填字母代号)。
A.t0t1 B.t1t2 C.t2t3 D.t3t4 E.t4t5 F.t5t6
②判断t1、t3、t4时刻分别改变的一个条件是:t1时刻___;t3时刻___;t4时刻___。 (填字母代号)
A. 增大压强 B.减小压强 C.升高温度 D. 降低温度 E.加催化剂 F.恒温恒容时充入氮气
③依据上述②中的结论,下列时间段中,氨的百分含量最高的是___(填字母代号)。
A.t0t1 B.t2t3 C.t3t4 D.t5t6。
【答案】3X+Y![]() 2Z 0.05molL1min1 0.9 增大 放热 ACDF C E B A
2Z 0.05molL1min1 0.9 增大 放热 ACDF C E B A
【解析】
(1)随反应进行反应物的物质的量减小,生成物的物质的量增大,X、Y是反应物、Z是生成物,2分钟内X、Y、Z的变化量分别是0.3、0.1、0.2,系数比等于变化量比;反应结束各物质的物质的量为定值,反应为可逆反应,反应方程式是3X+Y![]() 2Z;
2Z;
(2)反应开始至2min,气体Z的平均反应速率为v(Z)=![]() 0.05molL1min1;
0.05molL1min1;
(3)①同温、同体积,压强与物质的量成正比,![]() 0.9,所以平衡时压强是开始时的0.9倍;
0.9,所以平衡时压强是开始时的0.9倍;
②反应后气体质量不变,物质的量减少,根据![]() ,达平衡时,容器内混合气体的平均相对分子质量比起始投料时增大;
,达平衡时,容器内混合气体的平均相对分子质量比起始投料时增大;
③增大压强,平衡向气体系数和减小的方向移动,将容器的体积缩小为原来的![]() 倍,相当于加压,平衡正向移动,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为放热反应;
倍,相当于加压,平衡正向移动,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为放热反应;
(4) ①平衡时正逆反应速率相等,处于平衡状态的时间段是t0t1、t2t3、.t3t4、t5t6,选ACDF;
②根据图示,t1时刻正逆反应速率均突然增大,平衡逆向移动,改变的条件是升高温度,选C;t3时刻正逆反应速率同等程度增大,平衡不移动,改变条件是加入催化剂,选E;t4时刻正逆反应速率均突然减小,平衡逆向移动,改变条件是减小压强,选B。
③平衡逆向移动,氨气的百分含量减小,t1t2平衡逆向移动,,t3t4平衡不移动, t4t5平衡逆向移动,,t5t6平衡不移动,氨的百分含量最高的是t0t1,选A。