题目内容
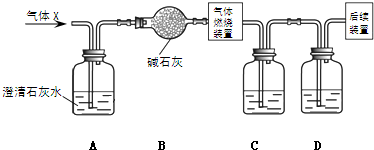
某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几种.将X通过适量的氯水时,X恰好完全被吸收,没有任何气体剩余.将所得的无色溶液分装于两支试管后,分别加入酸化的AgNO3与BaCl2溶液,结果均产生白色沉淀.下?推论不正确的是( )
分析:通过适量的氯水时,X恰好完全被吸收,没有任何气体剩余,证明一定没有二氧化碳;分别加入酸化的AgNO3与BaCl2溶液,结果均产生白色沉淀,不能证明氯化氢的存在,能够证明一定含有二氧化硫,再逐项分析判断.
解答:解:“适量的氯水”,“没有任何气体剩余”,说明一定没有CO2,可能有SO2、HCl、HBr;“无色溶液、分别加入酸化的AgNO3与BaCl2溶液,结果均产生白色沉淀”,证明加入氯化钡溶液,沉淀是硫酸钡一定含有SO2,但是无法证明HCl,因为前面加入了氯水,无色溶液说明没有HBr;
A、X中可能含有HCl,故A正确;
B、X中一定有SO2,故B正确;
C、X中可能没有HBr,故C错误;
D、白色沉淀分别为氯化银和硫酸钡,故D正确;
故选C.
A、X中可能含有HCl,故A正确;
B、X中一定有SO2,故B正确;
C、X中可能没有HBr,故C错误;
D、白色沉淀分别为氯化银和硫酸钡,故D正确;
故选C.
点评:本题属于查离子推断,关键是正确提取题中的信息,做出合理推断,本题难度一般.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目


 如图,X和Y均为石墨电极:
如图,X和Y均为石墨电极: