题目内容
【题目】某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
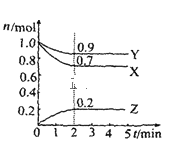
(1)该反应的化学方程式为:______。
(2)反应开始至2min,用Z表示的平均反应速率为:______。
(3)下列叙述能说明上述反应达到化学平衡状态的是______(填序号):
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入amolX(g)和bmolY(g),发生反应X(g)+Y(g)═2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:_____ ②恒容通入氦气:_____③使用催化剂:______
【答案】3X+Y2Z 0.05mol/(Lmin) AB 减小 不变 增大
【解析】
根据图像可知,X、Y为反应物,2min时达到平衡状态,变化量为0.3mol、0.1mol,Z为生成物,变化量为0.2mol,变化量之比等于化学计量数之比,则计量数之比为3:1:2,方程式为3X+Y2Z。
(1)图像可知,X、Y、Z的变化量分别为0.3mol、0.1mol、0.2mol,则计量数之比为3:1:2,方程式为3X+Y2Z;
(2)v(Z)=c/t=0.2/(2×2)=0.05mol/(Lmin);
(3)A.反应体系中,可逆号两边气体计量数的和不相等,则反应达到平衡状态时,混合气体的总物质的量不随时间的变化而变化,符合题意,A正确;
B.反应体系中,可逆号两边气体计量数的和不相等,容器为恒容,若达到平衡状态时,混合气体的物质的量不再改变,则压强不随时间的变化而变化,符合题意,B正确;
C.反应自始至终,单位时间内每消耗3molX,同时生成2molZ,不能确定是否达到平衡状态,与题意不符,C错误;
D.反应体系中,所有物质均为气体,则混合气体的总质量一直不变,气体总质量不变不能判断是否达到平衡状态,与题意不符,D错误;
答案为AB;
(4)①降低温度导致活化分子数目减少,有效碰撞的几率降低,反应速率减小;
②恒容通入氦气,反应体系中的各量的浓度未发生变化,则反应速率不变;
③使用催化剂可降低反应的活化能,活化分子数目增多,有效碰撞几率增大,反应速率增大。

【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
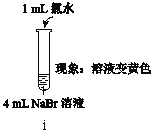
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__。
(3)①甲同学认为:实验Ⅱ观察到__现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先③步骤步骤,,,,,加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是__。
(4)综合实验Ⅰ和Ⅲ,得出氧化性Cl2>Br2>I2。