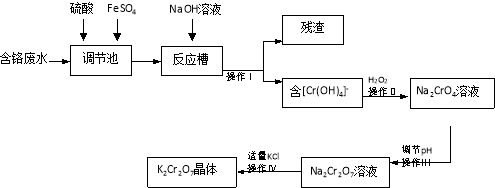
��Ŀ����
����Ŀ��̼����͵�Ԫ�ؼ��仯����Ĵ���������Դ���úͻ�����������Ҫ�о����⡣
��1��CO��ת���ɶ����ѣ�ԭ��Ϊ��2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
��֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2)/n(CO)]�ı仯����


���¶����ߣ���Ӧ��ƽ�ⳣ��K�� ������������������С����������������
��2��SO2��ˮ��Һ�����ԣ�ij�¶��£�0.02mol��L-1������ˮ��Һ��pH����2��������������Ķ��������H2O�ĵ��룬����¶����������һ�����볣��Ka1= ��
��3����֪����Ӧ1��2SO2(g)+O2(g) ![]() 2SO3(g) ��H1��
2SO3(g) ��H1��
��Ӧ2��2NO(g)+O2(g) ![]() 2NO2(g) ��H2��
2NO2(g) ��H2��
����H1<��H2<0����Ӧ3��SO2(g)+NO2(g) ![]() SO3(g)+NO(g)���� ��������������������������Ӧ��
SO3(g)+NO(g)���� ��������������������������Ӧ��
��4����������NaOH��Һ����SO2���壬�Բ���NaHSO3��һ�������Ƶ����ᣬ���ԭ��ʾ��ͼ������ͼ�������ʱ�����ĵ缫��ӦʽΪ ��
��5���ں����ܱ�������ͨ��SO2��NO2��1mol������Ӧ3��SO2(g)+NO2(g) ![]() SO3(g)+NO(g)������Ӧ�ﵽƽ���ά���¶Ⱥ��ݻ����䣬10minʱ��ͨ���1mol��SO2��NO2�Ļ�����壬20minʱ�ٴ�ƽ�⡣����ƽ��ʱNO2��ת������1 ��2������>������<������=������������ͼ�л�������Ӧ����v����10��30min����ʱ��仯������ͼ��
SO3(g)+NO(g)������Ӧ�ﵽƽ���ά���¶Ⱥ��ݻ����䣬10minʱ��ͨ���1mol��SO2��NO2�Ļ�����壬20minʱ�ٴ�ƽ�⡣����ƽ��ʱNO2��ת������1 ��2������>������<������=������������ͼ�л�������Ӧ����v����10��30min����ʱ��仯������ͼ��

���𰸡���1����С��(2)Ka1=1.0��10��2��(3)���ȣ�
(4)HSO3����2e����H2O=SO42����3H����
(5)=�� ��
��
��������
�����������1�������¶ȵ����ߣ�CO��ת���ʽ��ͣ�������������ԭ���������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ��������淴Ӧ�����ƶ�����ѧƽ�ⳣ����С�� (2)���������ڶ�Ԫ���ᣬ���Զ������룬H2SO3![]() H����HSO3�������ݵ���ƽ�ⳣ���Ķ��壬Ka1=c(H��)��c(HSO3��)/c(H2SO3)=10��2��10��2/(0.02��10��2)= 1.0��10��2����3��(��Ӧ1����Ӧ2)/2�ó���Ӧ������H=����H1����H2��/2����Ϊ��H1<��H2<0������H1����H2��/2<0����˷�Ӧ3�Ƿ��ȷ�Ӧ��(4)����Դ�����������ĵ缫Ϊ���������Ҷ�Ϊ����������ʧ���ӻ��ϼ����ߣ���˵缫��ӦʽΪ��HSO3����H2O��2e��=SO42����3H����(5)��Ӧǰ������ϵ��֮����ȣ�����ƽ��Ϊ��Чƽ�⣬��ת������ȣ�������Ӧ��Ũ�ȣ�����Ӧ��������ƽ��������Ӧ�����ƶ������ͼ��Ϊ��
H����HSO3�������ݵ���ƽ�ⳣ���Ķ��壬Ka1=c(H��)��c(HSO3��)/c(H2SO3)=10��2��10��2/(0.02��10��2)= 1.0��10��2����3��(��Ӧ1����Ӧ2)/2�ó���Ӧ������H=����H1����H2��/2����Ϊ��H1<��H2<0������H1����H2��/2<0����˷�Ӧ3�Ƿ��ȷ�Ӧ��(4)����Դ�����������ĵ缫Ϊ���������Ҷ�Ϊ����������ʧ���ӻ��ϼ����ߣ���˵缫��ӦʽΪ��HSO3����H2O��2e��=SO42����3H����(5)��Ӧǰ������ϵ��֮����ȣ�����ƽ��Ϊ��Чƽ�⣬��ת������ȣ�������Ӧ��Ũ�ȣ�����Ӧ��������ƽ��������Ӧ�����ƶ������ͼ��Ϊ�� ��
��

 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д� ״Ԫ����ϵ�д�
״Ԫ����ϵ�д�