题目内容
某温度下,0.1mol?L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A.溶液中碳酸氢根电离的氢离子浓度为10-10mol?L-1 |
| B.c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C.溶液中水电离的氢氧根离子浓度为10-4mol?L-1 |
| D.c(Na+)+c(H+)=c(HCO3-)+c(OH-) |
A、0.1mol?L-1NaHCO3溶液pH=10,碳酸氢根离子水解大于电离,溶液呈碱性,氢离子浓度为10-9mol/L,是水电离剩余在溶液中氢离子浓度,不是碳酸氢根电离出的氢离子,故A错误;
B、0.1mol?L-1NaHCO3溶液pH=10,碳酸氢根离子水解大于电离,溶液呈碱性,溶液中离子浓度大小为c(Na+)>c(HCO3-)>c(OH-)>c(H+),故B错误;
C、常温下,依据溶液中离子积常数计算溶液中水电离的氢氧根离子浓度为10-4mol?L-1,故C正确;
D、0.1mol?L-1NaHCO3溶液pH=10,溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故D错误;
故选C.
B、0.1mol?L-1NaHCO3溶液pH=10,碳酸氢根离子水解大于电离,溶液呈碱性,溶液中离子浓度大小为c(Na+)>c(HCO3-)>c(OH-)>c(H+),故B错误;
C、常温下,依据溶液中离子积常数计算溶液中水电离的氢氧根离子浓度为10-4mol?L-1,故C正确;
D、0.1mol?L-1NaHCO3溶液pH=10,溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故D错误;
故选C.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
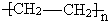 的单体是______.
的单体是______.