题目内容
【题目】回答下列问题:
(1)已知下列反应:SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2 CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。(用ΔH1 ΔH2ΔH3表示)
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ·mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ·mol﹣1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应.若x=0.2时,反应①放出的能量为 kJ;若x= 时,反应①与②放出(或吸收)的总能量为0。
(4) 一定条件,在水溶液中1 mol Cl-和1 mol ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示
。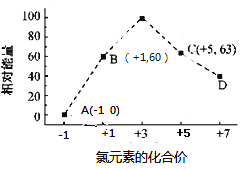
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
【答案】(1)△H1+△H2-△H3;(2)H2(g)+Cl2(g)=2HCl(g)△H=﹣183 kJ/mol;
(3)H2(g)+1/2O2(g)═H2O(g)△H=﹣252 kJ/mol;14.4;0.75.
(4)ClO4- 3ClO-(aq)= ClO3-(aq)+2Cl-(aq) △H=﹣117 kJ/mol
【解析】
试题分析:(1)已知:① SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
② ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2
③CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则根据个塑料袋可知①+②-③即得到反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq)=CaSO4(s) +H2O(l) +Cl (aq)的ΔH=△H1+△H2-△H3。
(2)反应热等于反应物中键能之和与生成物中键能之和的差值,则该反应的反应热△H=436kJ/mol+243kJ/mol-2×431kJ/mol=-183 kJ/mol,因此热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=﹣183 kJ/mol;
(3)已知:①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ·mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ·mol﹣1
则根据盖斯定律可知①÷2-②即得到氢气与氧气反应生成水蒸气的热化学方程式为H2(g)+1/2O2(g)═H2O(g)△H=﹣252 kJ/mol;x=0.2时,氧气是0.2mol,因此反应①中甲烷过量,则反应①放出的能量为72kJ/mol×0.2=14.4kJ;设氧气的物质的量是xmol,水蒸气的物质的量是1-x,反应①中放出的热量是72x。反应①与②放出(或吸收)的总能量为0,则反应②吸收的热量是72x,消耗水蒸气是![]() ,解得x=0.75。
,解得x=0.75。
(4)①D点氯元素的化合价是+7价,则该处是ClO4-。
②根据化合价可知B点是次氯酸根离子,C点是氯酸根离子,A点是氯离子,反应的方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq),其中反应热△H=63 kJ/mol +0-3×60 kJ/mol=-117 kJ/mol,则B→A+C反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=﹣117 kJ/mol。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案