题目内容
【题目】实验室迅速制备少量氯气可利用如下反应:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平),此反应常温下就可以迅速进行。请回答下列问题:
(1)上述反应中被氧化的元素是_________。当生成3.36L(标准状况下)Cl2时,转移电子的物质的量为_________。
(2)如果上述化学方程式中KMnO4化学计量数是1,则HCl的化学计量数是_________。
(3)实验室通常利用MnO2与浓盐酸共热反应制得氯气,据此可知KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为________。
(4)酸性KMnO4溶液与Fe2+反应生成Mn2+,该反应的离子方程式是________。
(5)下列物质既有氧化性,又有还原性的是________(填字母代号)。
A.I- B.HCl C.MnCl2 D. Cl2
【答案】![]() 0.3mol 8
0.3mol 8 ![]()
![]() BCD
BCD
【解析】
比较氧化还原反应中物质的氧化性和还原性时,若两物质在同一反应中,则满足氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物;若两物质在两个不同反应中时,可借助一个“桥”,即第三者产生联系,若找不到第三者,需比较反应条件,反应条件越高,氧化剂的氧化能力或还原剂的还原能力越弱。
对于反应KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O,KMnO4+5e-→MnCl2,2HCl-2e-→Cl2↑,依据电子守恒,则为2KMnO4+10e-→2MnCl2,10HCl-10e-→5Cl2↑,再考虑质量守恒,即可配平2KCl+2MnCl2,最后配HCl。因为前面配的只是表现出还原性的部分,生成(2KCl+2MnCl2)的部分表现出酸性,于是得出配平后的方程式为2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O;
(1)上述反应中,HCl中的Cl由-1价升高到0价,则被氧化的元素是Cl。当生成3.36L(标准状况下)Cl2时,n(Cl2)=![]() =0.15mol,由Cl2—2e-,可得出转移电子的物质的量为0.15mol×2=0.3mol;
=0.15mol,由Cl2—2e-,可得出转移电子的物质的量为0.15mol×2=0.3mol;
答案为:Cl;0.3mol;
(2)上述化学方程式中,2KMnO4——16HCl;若KMnO4化学计量数是1,则HCl的化学计量数是8;
答案为:8;
(3)在2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化性KMnO4> Cl2;在MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,氧化性MnO2> Cl2,那么KMnO4与MnO2的氧化性哪个更强?因为找不到可联系二者的物质,所以我们只能利用反应条件,前一反应不需条件,后一反应需加热,所以氧化性KMnO4>MnO2。从而得出氧化性KMnO4>MnO2>Cl2;
MnCl2+Cl2↑+2H2O中,氧化性MnO2> Cl2,那么KMnO4与MnO2的氧化性哪个更强?因为找不到可联系二者的物质,所以我们只能利用反应条件,前一反应不需条件,后一反应需加热,所以氧化性KMnO4>MnO2。从而得出氧化性KMnO4>MnO2>Cl2;
答案为:KMnO4>MnO2>Cl2;
(4)酸性KMnO4溶液与Fe2+反应生成Mn2+,该反应的离子方程式是5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O;
答案为:5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O;
(5) A.I-化合价为最低价,只能失电子,即只具有还原性,A不合题意;
B.HCl中,H+具有氧化性,Cl-具有还原性,B符合题意;
C.MnCl2中,Mn2+价态既能升高又能降低,既具有氧化性又具有还原性,C符合题意;
D.Cl2中,Cl的价态既能升高又能降低,D符合题意;
答案为:BCD。

【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
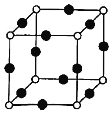
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。