题目内容
【题目】海水中Mg元素只要以MgCl2的形式存在,海水提镁的主要流程如下:

(1)下列说法不正确的是___________。
A.试剂M是盐酸 B.生石灰在食品工业中常用于防潮剂
C.操作b只是过滤 D.MgCl2电解为Mg时,Mg2+得到的电子数为2NA
(2)沉淀池中的主要反应化学方程式为________________________________。
(3)为了得到纯净的Mg(OH)2,操作a是_________,实验室洗涤沉淀的具体操作是___________________。
(4)已知常温下Ca(OH)2溶解度为m 克,则饱和石灰水的质量分数为_____________(列出计算的表达式即可,下同),若饱和石灰水密度为1g/mL,则饱和石灰水溶液的物质的量浓度为___________________。
【答案】 CD MgCl2+Ca(OH)2=Mg(OH)2+CaCl2 过滤 向漏斗中加入蒸馏水,浸没固体,低于滤纸边缘,静置流下,重复2~3次 ![]()
![]()
【解析】(1)A.由氢氧化镁生成氯化镁应加入稀盐酸,试剂M是盐酸,A正确;B.生石灰能与水反应具有很好的吸水性,可作食品工业中的防潮剂,B正确;C.氯化镁溶液需要蒸发浓缩结晶过滤等一系列操作才能得到氯化镁晶体,C错误;D.MgCl2电解为Mg时,每摩尔Mg2+得到的电子数为2NA,D错误,答案CD;(2)沉淀池中得到氢氧化镁,发生反应的化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2+CaCl2;(3)为了得到纯净的Mg(OH)2,要对沉淀过滤与多次洗涤,实验室洗涤沉淀的正确操作是向漏斗中加入蒸馏水,浸没固体,低于滤纸边缘,静置流下,重复2~3次;(4)设溶剂为100g,则此时溶解的Ca(OH)2的质量mg,因此饱和石灰水的质量分数为![]() ;饱和石灰水密度约为1g/mL,则根据
;饱和石灰水密度约为1g/mL,则根据![]() 可知物质的量浓度为
可知物质的量浓度为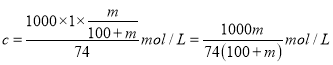 。
。