题目内容
(1)在标准状况下,1g 氢气中含有n个氢分子,则阿伏伽德罗常数用n表示为______;
(2)当SO2和SO3分子个数比为1:1 时,原子总数之比为______,质量之比为______;
(3)将5mol/L的Mg(NO3)2溶液10mL稀释至100mL,稀释后溶液中NO3-的物质的量浓度是______;
(4)现有10克由2H和16O组成的水分子,其中含中子数为______mol,电子数为______mol.
解:(1)在标准状况下,1g 氢气中含有n个氢分子,依据金属关系得到: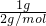 =
= ,NA=2n mol-1;
,NA=2n mol-1;
故答案为:2n mol-1;
(2)当SO2和SO3分子个数比为1:1 时,原子总数之比为:3:4;质量之比=64:80=4:5;故答案为:3:4;4:5;
(3)将5mol/L的Mg(NO3)2溶液10mL稀释至100mL,稀释后溶液中Mg(NO3)的物质的量浓度= =0.5mol/L,C(NO3-)=1mol/L;故答案为:1mol/L;
=0.5mol/L,C(NO3-)=1mol/L;故答案为:1mol/L;
(4)10克由2H和16O组成的水分子物质的量= 0.5mol;中子数=0.5mol×[(2-1)×2+16-8]=5mol;电子数=0.5mol×(2×1+8)=5mol;
0.5mol;中子数=0.5mol×[(2-1)×2+16-8]=5mol;电子数=0.5mol×(2×1+8)=5mol;
故答案为:5; 5;
分析:(1)依据n= =
=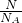 计算分析判断;
计算分析判断;
(2)依据分子数之比等于物质的量之比,结合化学式进行计算;
(3)依据溶液稀释过程中溶质物质的量不变计算判断;
(4)质量换算物质的量,结合中子数+质子数=质量数,计算分析;
点评:本题考查了物质的量与各量的换算关系应用,溶液稀释实质,质量数与质子数、中子数的计算关系,掌握基础是解题关键,题目较简单.
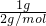 =
= ,NA=2n mol-1;
,NA=2n mol-1; 故答案为:2n mol-1;
(2)当SO2和SO3分子个数比为1:1 时,原子总数之比为:3:4;质量之比=64:80=4:5;故答案为:3:4;4:5;
(3)将5mol/L的Mg(NO3)2溶液10mL稀释至100mL,稀释后溶液中Mg(NO3)的物质的量浓度=
 =0.5mol/L,C(NO3-)=1mol/L;故答案为:1mol/L;
=0.5mol/L,C(NO3-)=1mol/L;故答案为:1mol/L;(4)10克由2H和16O组成的水分子物质的量=
 0.5mol;中子数=0.5mol×[(2-1)×2+16-8]=5mol;电子数=0.5mol×(2×1+8)=5mol;
0.5mol;中子数=0.5mol×[(2-1)×2+16-8]=5mol;电子数=0.5mol×(2×1+8)=5mol;故答案为:5; 5;
分析:(1)依据n=
 =
=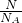 计算分析判断;
计算分析判断;(2)依据分子数之比等于物质的量之比,结合化学式进行计算;
(3)依据溶液稀释过程中溶质物质的量不变计算判断;
(4)质量换算物质的量,结合中子数+质子数=质量数,计算分析;
点评:本题考查了物质的量与各量的换算关系应用,溶液稀释实质,质量数与质子数、中子数的计算关系,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
下列关于气体摩尔体积的几种说法正确的是( )
| A、22.4 L任何气体的物质的量均为1 mol | B、标准状况下,1 mol物质的体积为22.4 L | C、H2、O2、N2、CO2组成的混合气体1 mol在标准状况下的体积约为22.4 L | D、在同温同压下,相同体积的任何气体单质所含分子数和原子数都相同 |
 (1)在标准状况下,气体A的密度为1.25g/L,气体B相对于氢气的密度为21,若8.96LA和B的混合气体的质量为13.44g,则混合物中A与B的体积比为
(1)在标准状况下,气体A的密度为1.25g/L,气体B相对于氢气的密度为21,若8.96LA和B的混合气体的质量为13.44g,则混合物中A与B的体积比为