题目内容
下表是元素周期表的一部分,针对表中的 ①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,最易失电子的元素是
(2)化学性质最不活泼的元素的原子结构示意图为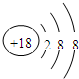
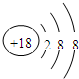
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是
(4)在③~⑦元素中,原子半径最大的是
(5)在⑦与⑩的单质中,氧化性强的是
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
K
K
,非金属性最强的元素是F
F
(2)化学性质最不活泼的元素的原子结构示意图为
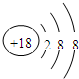
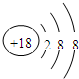
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是
HClO4
HClO4
,碱性最强的碱是KOH
KOH
,呈两性的氢氧化物是Al(OH)3
Al(OH)3
;(4)在③~⑦元素中,原子半径最大的是
Na
Na
,原子半径最小的是Cl
Cl
;(5)在⑦与⑩的单质中,氧化性强的是
Cl2
Cl2
,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2
2NaBr+Cl2=2NaCl+Br2
.分析:(1)根据元素周期表中金属性和非金属性的递变规律来回答;
(2)根据原子结构示意图的画法来画;
(3)根据元素周期律的知识来回答;
(4)同一周期元素原子半径从左到右半径在减小;
(5)同一主族从上到下单质的氧化性逐渐减弱,可以根据单质间的置换反应来证明.
(2)根据原子结构示意图的画法来画;
(3)根据元素周期律的知识来回答;
(4)同一周期元素原子半径从左到右半径在减小;
(5)同一主族从上到下单质的氧化性逐渐减弱,可以根据单质间的置换反应来证明.
解答:解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,所以失电子能力最强的是K,得电子能力最强的是F,得电子能力强则元素的非金属性就强,故答案为:K;F;
(2)上述元素中只有Ar原子的最外层电子数为8,性质不活泼,原子结构示意图为: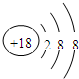 ,故答案为:
,故答案为: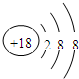 ;
;
(3)根据元素周期律:周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,元素非金属性逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,元素非金属性逐渐减弱,上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;
(4)同一周期,元素原子半径从左到右半径在减小,则Na的原子半径最大,Cl的最小,故答案为:Na;Cl;
(5)同主族从上到下,单质的氧化性逐渐增强,所以氯气的氧化性强于溴单质,可以通过水溶液中的置换反应来证明,即2NaBr+Cl2=2NaCl+Br2,
故答案为:Cl2;2NaBr+Cl2=2NaCl+Br2.
(1)周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,所以失电子能力最强的是K,得电子能力最强的是F,得电子能力强则元素的非金属性就强,故答案为:K;F;
(2)上述元素中只有Ar原子的最外层电子数为8,性质不活泼,原子结构示意图为:
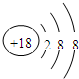 ,故答案为:
,故答案为: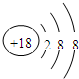 ;
;(3)根据元素周期律:周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,元素非金属性逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,元素非金属性逐渐减弱,上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;
(4)同一周期,元素原子半径从左到右半径在减小,则Na的原子半径最大,Cl的最小,故答案为:Na;Cl;
(5)同主族从上到下,单质的氧化性逐渐增强,所以氯气的氧化性强于溴单质,可以通过水溶液中的置换反应来证明,即2NaBr+Cl2=2NaCl+Br2,
故答案为:Cl2;2NaBr+Cl2=2NaCl+Br2.
点评:本题考查位置、结构、性质的应用,元素的推断较简单,学生熟悉元素在周期表中的位置及元素、单质、化合物的性质即可解答,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是