题目内容
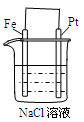
某原电池装置如下图所示。下列有关叙述中,正确的是
A. 作正极,发生氧化反应 作正极,发生氧化反应 | B.工作一段时间后,两烧杯中溶解 均不变 均不变 |
C.负极反应: | D.工作一段时间后,NaCl溶液中c(Cl-)增大 |
D
解析试题分析:该装置是原电池。A.在该原电池中,Fe作负极,发生氧化反应,错误;B. 工作一段时间后,左边的烧杯会含有大量的Fe2+,溶液的pH减小,右边中的H+不断放电产生氢气,因此烧杯中溶解pH会逐渐增大,错误;C. 负极反应是Fe-2e-=Fe2+,错误;D. 工作一段时间后,NaCl溶液中由于Fe2+不断氧化进入溶液,根据溶液呈电中性原理,盐桥中的Cl-会进入到左边的烧杯中,该该烧杯中c(Cl-)增大,正确。
考点:考查原电池反应中原理及电极反应、溶液中离子浓度变化的知识。

粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是 ;
H2O2参加反应的离子方程式为 。
(2)加稀氨水调节pH的目的是 ,pH应调至 范围。下列物质可用来替代稀氨水的是 。
①NaOH ②Fe2O3 ③CuO ④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括 、 、
过滤、 、干燥等步骤。
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O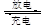 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是( )
| A.充电过程是化学能转化为电能的过程 |
| B.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
| C.放电时负极附近溶液的碱性增强 |
| D.放电时电解质溶液中的OH-向正极移动 |
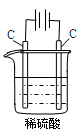
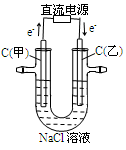
下列说法不正确的是
| A. | B. | C. | D. |
| 通电一段时间后,搅拌均匀,溶液的pH增大 | 甲电极上的电极反应为: 2Cl- -2e- = Cl2↑ | Pt电极上的电极反应为:O2+2H2O+4e-==4OH- | 总反应的离子方程式为: 2Fe3++Cu=Cu2++ 2Fe2+ |
 |  |  |  |
在下图所示的原电池中,正极发生的反应是
A.2H++2e― H2↑ H2↑ | B.Cu–2e― Cu2+ Cu2+ |
C.Cu2++2e― Cu Cu | D.Zn–2e― Zn2+ Zn2+ |
对于锌-铜-稀H2SO4组成的原电池装置中,当导线中有1mol电子通过时理论上的电极变化:
①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出了1g H2 ④铜片上析出1molH2
| A.①③ | B.①④ | C.②③ | D.②④ |
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲的质量减少;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
| A.甲>乙>丙>丁 | B.甲>丙>乙>丁 |
| C.甲>丙>丁>乙 | D.乙>丁>丙>甲 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。下列说法不正确的是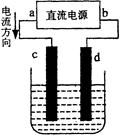
| A.a为正极、b为负极 |
| B.c为阳极、d为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |