题目内容
12.下列排列顺序正确的是( )| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
分析 A、含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高;
B、同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大判断;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、元素的非金属性越强,对应的氢化物越稳定.
解答 解:A、含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,所以沸点:H2O>HF>HCl,故A正确;
B、同周期元素从左到右原子半径逐渐减小,则原子半径Na>Mg,一般来说,原子核外电子层数越多,原子半径越大,则Na>Mg>O,故B错误;
C、非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H3PO4<H2SO4<HClO4 故C错误;
D、非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故D错误;故选A.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
7.500mL NaNO3 和Cu(NO3)2混合溶液中c(NO3- )=6 mol/L,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到气体22.4L(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 原混合溶液中c(Na+ )=6mol/L | B. | 电解后溶液中c(H+)=4mol/L | ||
| C. | 上述电解过程中共转移8mol电子 | D. | 电解后得到的Cu的物质的量为2mol |
17.在标准状况下,1L丙烷和2L乙烷的混合气体在80L空气中完全燃烧,生成的气体经干燥后,其体积为( )
| A. | 85L | B. | 75L | C. | 73L | D. | 70L |
4.下面有关硅的叙述中,正确的是( )
| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |

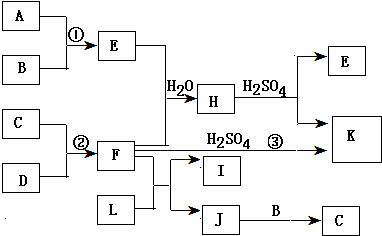
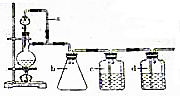 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.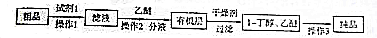
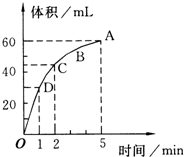 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题: