题目内容
(1)下面是某同学研究过氧化钠性质过程中的片断.请你帮助他完成部分实验并补全活动记录.
步骤Ⅰ:过氧化钠的颜色、状态: 色, 态.
步骤Ⅱ:类比氧化钠与水反应生成氢氧化钠的反应,过氧化钠与水反应可能有氢氧化钠生成.
步骤Ⅲ:取一个小烧杯,向其中加入少量的过氧化钠固体,然后加入适量的蒸馏水,充分振荡后,再向其中滴加酚酞溶液.现象①:用手触摸烧杯,感觉烫手,得出的结论是 ;现象②: ,原因是有碱生成,得出的结论是:生成的碱是氢氧化钠;现象③:有大量的气泡产生,现象④…
步骤Ⅳ:写出氧化钠和过氧化钠分别与水反应的化学方程式: , .
(2)在上述过程中,他用到了研究物质性质的方法有 .
步骤Ⅰ:过氧化钠的颜色、状态:
步骤Ⅱ:类比氧化钠与水反应生成氢氧化钠的反应,过氧化钠与水反应可能有氢氧化钠生成.
步骤Ⅲ:取一个小烧杯,向其中加入少量的过氧化钠固体,然后加入适量的蒸馏水,充分振荡后,再向其中滴加酚酞溶液.现象①:用手触摸烧杯,感觉烫手,得出的结论是
步骤Ⅳ:写出氧化钠和过氧化钠分别与水反应的化学方程式:
(2)在上述过程中,他用到了研究物质性质的方法有
考点:性质实验方案的设计
专题:实验设计题
分析:(1)过氧化钠是淡黄色的固体,过氧化钠可以和水反应生成氢氧化钠和氧气,反应放热并且生成的氢氧化钠具有碱性可以使酚酞变红,而氧化钠只能与水反应生成氢氧化钠,据此回答;
(2)从颜色状态是观察法,烫手、溶液变红是实验法,比较氧化钠与过氧化钠和水的反应又是比较法.
(2)从颜色状态是观察法,烫手、溶液变红是实验法,比较氧化钠与过氧化钠和水的反应又是比较法.
解答:
解:(1)过氧化钠是淡黄色的固体,过氧化钠可以和水反应生成氢氧化钠和氧气,即2Na2O2+2H2O=4NaOH+O2↑,反应放热并且生成的氢氧化钠具有碱性可以使酚酞变红,故答案为:淡黄;固;反应放热;溶液变红色;Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑;
(2)从颜色状态是观察法,烫手、溶液变红是实验法,比较氧化钠与过氧化钠和水的反应又是比较法,故答案为:观察法、实验法、比较法;
(2)从颜色状态是观察法,烫手、溶液变红是实验法,比较氧化钠与过氧化钠和水的反应又是比较法,故答案为:观察法、实验法、比较法;
点评:本题考查学生过氧化钠性质,注意知识的归纳和梳理是解题的关键,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
将2mol PCl3和1mol Cl2充人一容积不变的密闭容器中,在一定条件下反应:PCl3(g)+Cl2(g)?PCl 5(g)达平衡时,PC15为0.4mol.此时若移走1molPCl3和0.5molCl2,在相同温度下达平衡时PCl5的物质的量是( )
| A、0.4 mol |
| B、小于0.2 mol |
| C、0.2 mol |
| D、大于0.2 m01而小于0.4 mol |
下图为向25ml0.1mol/LNaOH溶液中逐滴0.2mol/L醋酸溶液,当滴定至B点时,pH=7,溶液呈中性,下列关系式错误的是( )
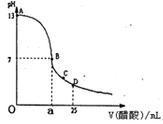

| A、c(H+)=c(OH-) |
| B、c(Na+)=c(CH3COO-) |
| C、a=12.5 |
| D、a>12.5 |
下列实验操作中,正确的是( )
| A、蒸发结晶时,应将溶液蒸干后才停止加热 |
| B、蒸馏中,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
| D、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释至刻度线 |
 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.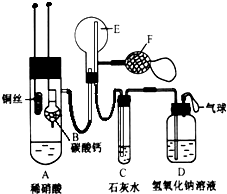 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.