题目内容
1. 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )| A. | 实验开始时需给a试管稍微加热 | |
| B. | 反应开始时铜片表面可以看到有黑色物质生成 | |
| C. | 将a试管里的溶液冷却后注入盛有水的烧杯中,溶液呈蓝色 | |
| D. | b试管中的溶液逐渐褪为无色,说明反应生成的气体,将品红氧化为无色 |
分析 A.铜与浓硫酸需要在加热条件下发生反应;
B.铜与浓硫酸的反应中会生成CuO及CuS、Cu2S等黑色物质;
C.反应生成了硫酸铜,硫酸铜溶液为蓝色溶液;
D.二氧化硫与品红溶液生成了一种不稳定的无色物质,所以品红溶液褪色,该反应不是氧化还原反应.
解答 解:A.铜与浓硫酸的反应中,加热可以加快反应速率,所以该反应需要在加热条件下进行,故A正确;
B.浓硫酸与铜共热反应是分步进行的,铜先被浓硫酸氧化为黑色的氧化铜,氧化铜再与硫酸反应生成硫酸铜,另外还伴有一些副反应生成CuS、Cu2S等黑色物质,故B正确;
C.将a试管里的溶液冷却后注入盛有水的烧杯中,由于反应生成了硫酸铜,则溶于水后溶液呈蓝色,故C正确;
D.该反应中生成的二氧化硫,所以b试管中品红溶液会褪色,二氧化硫的漂白性原理为:二氧化硫与品红溶液生成了一种不稳定的无色物质,加热后会恢复,该反应不是氧化还原反应,故D错误;
故选D.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握铜与浓硫酸的反应原理、反应现象及二氧化硫的检验方法,明确二氧化硫与次氯酸的漂白性实质,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.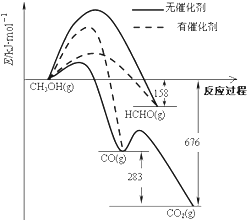 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )| A. | 未使用催化剂,氧化产物有三种 | |
| B. | 使用催化剂,氧化产物主要是CO或者HCHO | |
| C. | CH3OH的燃烧热大于676kJ•mol-1 | |
| D. | 2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1 |
8.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol•L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为( )
| A. | 2.8×10-2 mol•L-1 | B. | 1.4×10-5 mol•L-1 | ||
| C. | 2.8×10-5 mol•L-1 | D. | 5.6×10-5 mol•L-1 |
12.某甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸、和水等,某同学为了检验产品中的苯甲酸和硫酸,做了如下实验.(已知H2SO3:K1=1.3×10-2 K2=6.3×10-8,苯甲酸:Ka=6.46×10-5,碳酸;K1=4.30×10-7 K2=5.61×10-11)限选试剂:0.1 mol•L-1BaCl2溶液,0.1 mol•L-1Ba(OH)2溶液,1.0 mol•L-1Na2CO3溶液,1.0mol•L-1NaHCO3溶液,1 mol•L-1HCl溶液,1 mol•L-1Na2SO3溶液,1 mol•L-1NaHSO3溶液.
| 实验操作 | 实验现象及结论 |
| ①取粗产品于试管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度减小振荡分层,用分液漏斗分液,得到水层加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,说明含有硫酸 |
| ②取①反应后的溶液于试管中,加入1 mol•L-1HCl溶液 | 出现白色晶体,证明含有苯甲酸 |
13.某化学兴趣小组在一次实验活动中发现钠能在二氧化碳中燃烧,他们对钠在二氧化碳气体中燃烧后生成的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质.
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3
假设3:白色物质可能是Na2O和Na2CO3的混合物.
设计实验方案,验证假设
思考与交流:
(1)甲同学认为方案1得到的结论不正确,其理由是Na2CO3的水溶液显碱性,遇酚酞变红色
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象.
实验操作:滴加酚酞试液 实验现象:溶液颜色没有变化(上层清液是NaCl显中性)
(3)乙同学认为白色物质可能是NaOH,你填不同意(同意或不同意)该同学的观点,并简述理由:反应物中无氢元素,违背质量守恒定律
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质.
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3
假设3:白色物质可能是Na2O和Na2CO3的混合物.
设计实验方案,验证假设
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质是Na2O. |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCl2 | 有白色沉淀生成 | 白色物质是Na2CO3 |
| ②静置片刻,取上层清液于试管中… | …. |
(1)甲同学认为方案1得到的结论不正确,其理由是Na2CO3的水溶液显碱性,遇酚酞变红色
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象.
实验操作:滴加酚酞试液 实验现象:溶液颜色没有变化(上层清液是NaCl显中性)
(3)乙同学认为白色物质可能是NaOH,你填不同意(同意或不同意)该同学的观点,并简述理由:反应物中无氢元素,违背质量守恒定律
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
10.若某基态原子的外围电子排布为4d15s2,则下列说法错误的是( )
| A. | 该元素位于第5周期,ⅢB族 | B. | 该元素原子核外有5个电子层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M能层共有8个电子 |
11.关于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O下列说法错误的是( )
| A. | 每生成1mol单质硫,转移电子总数为2NA | |
| B. | 升高温度,生成硫沉淀的速率加快,说明升高温度可加快化学反应速率 | |
| C. | 增大压强对该反应的速率几乎没有影响 | |
| D. | 由于反应产生SO2气体,所以可以通过观察生成气泡的快慢比较稀、浓硫酸与Na2S2O3反应的速率大小 |
 C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.
C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.