题目内容
4.短周期元素的原子,处于基态时可能具有的电子是( )| A. | 只有s和p电子 | B. | 只有s电子 | C. | 只有p电子 | D. | 有s、p和d电子 |
分析 短周期元素的原子即1-18号,处于基态时其电子最多只能排到3p轨道,所以处于基态时可能具有的电子是只有s和p电子,据此分析.
解答 解:短周期元素的原子即1-18号,处于基态时其电子最多只能排到3p轨道,不可能排到3d轨道,所以处于基态时可能具有的电子是只有s和p电子,故选:A.
点评 本题主要考查了短周期元素的基态时其电子排布情况,掌握基态电子的排布式即可答题,比较简单.

练习册系列答案
相关题目
14.舍勒在研究一种白色盐时发现,在黑暗中这种盐并无气味,而在光照条件下变黑,并产生一种刺激性气味(无液体).这种盐是( )
| A. | AgBr | B. | AgI | C. | AgCl | D. | KClO3 |
15.向质量分数为2a%,体积为10mL物质的量浓度为c1 mol•L-1的稀H2SO4中加入V mL的水,使之质量分数变为a%,此时物质的量浓度为c2 mol•L-1,则下列关系正确的是( )
| A. | V>10 2c2=c1 | B. | V<10 2c2>c1 | C. | V>10 2c2<c1 | D. | V>10 2c2>c1 |
19.[Co(NH3)4](H2O)2]3+具有几何异体构体的数目是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
9.碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的,在下列三种晶体中:①金刚石,②晶体硅,③碳化硅,它们的熔点由高到低的是( )
| A. | ①③② | B. | ③②① | C. | ②③① | D. | ②①③ |
16.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域.已知只有质子数或中子数为奇数的原子核有NMR现象.试判断下列哪组原子均可产生NMR现象( )
| A. | ${\;}_{\;}^{18}$O ${\;}_{\;}^{31}$P ${\;}_{\;}^{119}$Sn | |
| B. | ${\;}_{\;}^{27}$Al ${\;}_{\;}^{19}$F ${\;}_{\;}^{12}$C | |
| C. | 元素周期表中V A族所有元素的原子 | |
| D. | 元素周期表中第一周期所有元素的原子 |
14.以下实验装置正确,且能达到实验目的是( )
| A. | 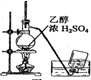 制备乙烯 | B. | 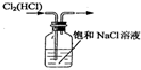 除去Cl2中的HCl | ||
| C. | 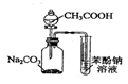 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 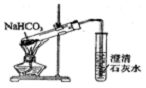 探究NaHCO3的热稳定性 |
 ②
② ③CH2Cl2 ④CCl4.
③CH2Cl2 ④CCl4.