题目内容
 Ⅰ(1)某温度下,纯水中的c (H+)=4.0×10-7 mol/L,则此温度下纯水中的
Ⅰ(1)某温度下,纯水中的c (H+)=4.0×10-7 mol/L,则此温度下纯水中的c(OH-)=
(2)在25℃时,100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合,混合后溶液的pH=
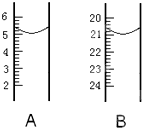
Ⅱ如图为中学常用定量仪器的部分结构(仪器被放大,单位mL),回答下列问题.
(1)写出两仪器名称:A
(2)写出两仪器的读数:A
(3)如果用B仪器取一定体积的液体,开始读数是平视刻度,结束读数是俯视刻度,则所取液体体积(填“偏大”、“偏小”或“不变”)
该温度下水的离子积Kw=4.0×10-7×4.0×10-7=1.6×10-13,根据Kw=c(H+)?c(OH-)计算溶液中c(H+).
Ⅱ、100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合,溶液呈碱性,计算剩余溶液中c(OH-),再根据Kw=c(H+)?c(OH-)计算溶液中c(H+),利用pH=-lgc(H+)计算;
(1)根据仪器的刻度特征可知,A为量筒,B为滴定管;
(2)量筒的为0.1;滴定管的精度为0.01.由图可知A的读数为5.0mL,B的读数为21.00mL;
(3)开始读数是平视刻度,结束读数是俯视刻度,目光与读数、溶液凹面一条线,使溶液凹液面在所需刻度的下方,所取液体体积偏大.
该温度下水的离子积Kw=4.0×10-7×4.0×10-7=1.6×10-13,根据Kw=c(H+)?c(OH-)计算实验
所以溶液中c(H+)=
| Kw |
| c(OH-) |
| 1.6×10-13 |
| 5.0×10-6 |
故答案为:4.0×10-7;3.2×10-8.
Ⅱ、100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合,溶液呈碱性,剩余溶液中n(OH-)=0.1L×(1.2mol/L-1.0mol/L)=0.02mol,溶液中c(OH-)=
| 0.02mol |
| 0.2L |
| 10-14 |
| 0.1 |
故答案为:13;
(1)根据仪器的刻度特征可知,A为量筒,B为滴定管,故答案为:量筒;滴定管;
(2)量筒的为0.1;滴定管的精度为0.01.由图可知A的读数为5.0mL,B的读数为21.00mL,
故答案为:5.0mL;21.00mL;
(3)开始读数是平视刻度,结束读数是俯视刻度,目光与读数、溶液凹面一条线,使溶液凹液面在所需刻度的下方,所取液体体积偏大,故答案为:偏大.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案(1)某温度下,纯水中c [H+]=2.0×10-7 mol/L,则此时c [OH-] = mol/L,水的离子积Kw= ;相同条件下,测得① Na2CO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
(2)pH值相同的 HCl(aq)、H2SO4(aq)、 CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 ;
②分别用0.1 mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是 。
③反应开始时,反应速率 。(从下面选项中选择填写)
| A.HCl最快; | B.H2SO4最快; | C.CH3COOH最快; | D.一样快 |
①溶液中c (OH-) c (H+) ②c (HCN) c (CN-)
(4)①Na2CO3溶液的pH 7(填“>、<、=”),
其原因是 (用离子方程式表示)
②若溶液Na2CO3溶液和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,该反应的离子方程式为
(5)下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数(mol2·L-2) | 1×10-14 | a | 1×10-12 |
①若25<t1<t2,则a__________1×10-14 mol2·L-2(填“>”、“<”或“=”),做此判断的理由是________________________。
②25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
③t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是_______ _____。
(1)某温度下,纯水中c [H+]=2.0×10-7 mol/L,则此时c [OH-] = mol/L,水的离子积Kw= ;相同条件下,测得① Na2CO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
(2)pH值相同的 HCl(aq)、H2SO4(aq)、 CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 ;
②分别用0.1 mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是 。
③反应开始时,反应速率 。(从下面选项中选择填写)
A.HCl最快; B.H2SO4最快; C.CH3COOH最快; D.一样快
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+) ②c (HCN) c (CN-)
(4)①Na2CO3溶液的pH 7(填“>、<、=”),
其原因是 (用离子方程式表示)
②若溶液Na2CO3溶液和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,该反应的离子方程式为
(5)下表是不同温度下水的离子积常数:
|
温度/℃ |
25 |
t1 |
t2 |
|
水的离子积常数(mol2·L-2) |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
①若25<t1<t2,则a__________1×10-14 mol2·L-2(填“>”、“<”或“=”),做此判断的理由是________________________。
②25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
③t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是_______ _____。
 H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH-