题目内容
(18分)
Ⅰ.某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
(2)恒定温度、压强
①若x = 0,y = 0,则z _________;
②x、y、z应满足的一般条件是_______________________________。
Ⅱ.将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)  2H2+O2、2CO+O2
2H2+O2、2CO+O2  2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_____和_____,或____和_____。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为: n(O2)平=a mol, n(CO2)平=b mol。
试求n(H2O)平=__________。(用含a、b的代数式表示)
Ⅰ(1) 2 ‚ 0.75 0.5 ƒ x+z/2=1 y+3z/2=3
(2) 任意数值 ‚ x/y=1/3;Z≧0
Ⅱ.(1)H2O、H2,CO、CO2 (2)(2-2a+b) mol
【解析】

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:

回答下列问题:(各元素用相应的元素符号表示)
⑴写出X和Y形成的化合物的电子式 。
⑵阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反
应的化学方程式
⑶写出反应②的化学方程式为 。
⑷某温度下在容积固定的密闭容器中,下列反应达到平衡:
M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=
—44kJ/mol,写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、
2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
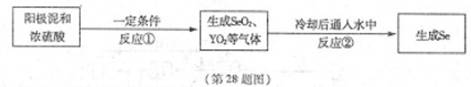
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)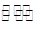 N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
 CO(g)+H2(g)△H=+131kJ?mol-1
CO(g)+H2(g)△H=+131kJ?mol-1 CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)
CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示) 2Cu+CO2
2Cu+CO2 2NO(g)
ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
2NO(g)
ΔH,已知该反应在 T ℃时,平衡常数K=9.0。