题目内容
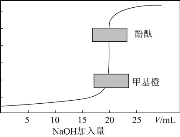
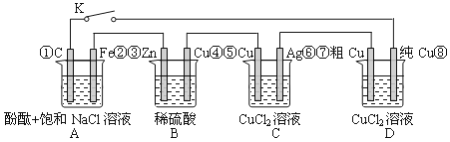
【题目】如下图,铁腐蚀由快到慢的顺序为(电解质溶液为水)

A.⑥>④>③>②>①>⑤B.⑤>③>①>②>④>⑥
C.⑤>④>①>②>③>⑥D.⑤>④>②>①>③>⑥
【答案】C
【解析】
根据图知,①③④装置是原电池,在④中,金属铁作负极,③中金属铁作正极,作负极的腐蚀速率快,两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,此外原电池原理引起的腐蚀>化学腐蚀,所以④>③>①,⑤⑥装置是电解池,⑤中金属铁为阳极,⑥中金属铁为阴极,阳极金属被腐蚀速率快,阴极被保护,即⑤>⑥,根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,②没有水的存在腐蚀速率很慢,即腐蚀速率⑤>④>①>②>③>⑥;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】空气中含有吸入颗粒物PM2.5,严重影响人的生理和健康,因此改善发质结构、机动车辆措施能有效减少PM2.5、SO2、NO3等的污染。请回答下列问题:
(1)将一定量的某PM2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下,测得该试样的组成及其浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断,该试样的pH = ________。
(2)汽车尾气中NOx和CO的生成。已知:气缸中生成NO的反应为N2(g)+O2(g)![]() 2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
A.混合气体的密度不再变化 B.混合气体的平均分子质量不再变化
C.N2、O2、NO的物质的量之比为1:1:2 D.氧气的转化率不再变化
E.生成lmol N2的间时有lmol O2被消耗
(3)为减少CO2、SO2的排放,常采取的措施如下:
①将煤转化为淸洁气体燃料。己知:H2(g)+1/2O2(g)= H2O(g) △H =-241.8kJ mol-1; C(s)+1/2O2(g)=CO(g) △H =-110.5kJ mol-1。写出焦炭与水蒸气反应的热化学方程式:_____________________________________。
②洗涤含SO2的烟气。下列物质,可作为洗涤含SO2烟气的洗涤剂的是______(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl3饱和溶液 D.酸性CaCl2饱和溶液
(4)某湿度下,反应2NO(g)+O2(g) ![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
判断的依据是__________________________________。
(5)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池的工作原理如图14所示,则通入a气体的电极,电极反应式为_________________。

(6)—定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为___________________。
【题目】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g)![]() CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应温度T/K | 500 | 500 | 600 |
反应物投入量 | 1 mol CO、 2 mol H2 | 2 mol CH3OH | 1 mol CO、 2 mol H2 |
平衡v正(H2)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡c(CH3OH)/(mol·L-1) | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(CO) | α2(CH3OH) | α3(CO) |
平衡常数K | K1 | K2 | K3 |
下列叙述正确的是( )
A. v1<v2,2c1>c2B. α1(CO)>α3(CO),v1<v3
C. p2>2p3,K1<K3D. c2>2c3,α2(CH3OH)+α3(CO)<1