题目内容
在一个密闭容器中,反应aA(g) bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
 bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 [ ]
A.物质A的转化率小了
B.平衡向正反应方向移动了
C.物质B的质量分数减小了
D.a < b
B.平衡向正反应方向移动了
C.物质B的质量分数减小了
D.a < b
BD

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目



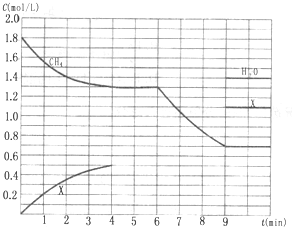 向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有: KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.