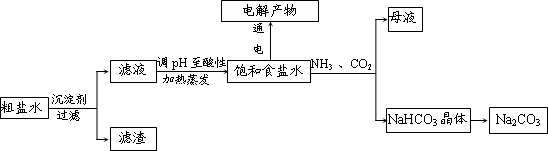
题目内容
“84消毒液”与硫酸溶液反应可以制取氯气,反应方程式为:NaClO+NaCl+H2SO4
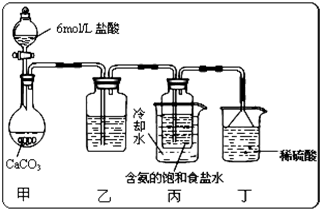
Na2SO4+Cl2↑+H2O. 为探究氯气的性质,某同学设计了如下所示的实验装置

请回答:
(1)从①、②、③装置中选择合适的制气装置(A处)______(填写序号).
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是______,说明该装置存在明显的缺陷,请提出合理的改进的方法______.
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式______.
(4)写出氯气与氢氧化钠溶液反应的化学方程式______,为验证尾气吸收后的溶液中存在氯离子,正确的操作为______.
(5)已知RCH2COOH和Cl2在红磷存在时发生取代反应生成RCHClCOOH.现有分子式为C4H8O2的羧酸A,发生如下变化.

E的分子式为C8H12O4,E的核磁共振氢谱显示只有一个峰.写出E的结构简式______.
| ||

请回答:
(1)从①、②、③装置中选择合适的制气装置(A处)______(填写序号).
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是______,说明该装置存在明显的缺陷,请提出合理的改进的方法______.
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式______.
(4)写出氯气与氢氧化钠溶液反应的化学方程式______,为验证尾气吸收后的溶液中存在氯离子,正确的操作为______.
(5)已知RCH2COOH和Cl2在红磷存在时发生取代反应生成RCHClCOOH.现有分子式为C4H8O2的羧酸A,发生如下变化.

E的分子式为C8H12O4,E的核磁共振氢谱显示只有一个峰.写出E的结构简式______.
(1)由NaClO+NaCl+H2SO4
Na2SO4+Cl2↑+H2O可知,反应有液体参加,需要加热,所以选装置②.
故答案为:②.
(2)装置B中干燥的有色布条褪色,Cl2中可能混有少量的水蒸气,应在在A和B之间增加盛有浓H2SO4的洗气瓶,除去Cl2中的水蒸气.
故答案为:Cl2中混有少量的水蒸气;在A和B 之间增加盛有浓H2SO4的洗气瓶,除去Cl2中的水蒸气.
(3)氯气把 SO32-氧化为SO42-,自身被还原为Cl-,反应离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠、水,反应化学方程式为 Cl2+2NaOH=NaCl+NaClO+H2O;检验氯离子的操作为:取少量溶液于试管中,先加HNO3调节pH为酸性,在加AgNO3溶液,如有白色沉淀生成,证明原溶液中有Cl-.
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;取少量溶液于试管中,先加HNO3调节pH为酸性,在加AgNO3溶液,如有白色沉淀生成,证明原溶液中有Cl-.
(5)由题目信息及转化关系可知,B为C3H7ClCOOH,D为C3H7(OH)COOH,E的分子式为C8H12O4,E为环酯,E的核磁共振氢谱显示只有一个峰,分子中含有4个甲基,故A中含有2个甲基,所以B为C(CH3)2ClCOOH,D为C(CH3)2(OH)COOH,所以E的结构简式为

.
故答案为:

.
| ||
故答案为:②.
(2)装置B中干燥的有色布条褪色,Cl2中可能混有少量的水蒸气,应在在A和B之间增加盛有浓H2SO4的洗气瓶,除去Cl2中的水蒸气.
故答案为:Cl2中混有少量的水蒸气;在A和B 之间增加盛有浓H2SO4的洗气瓶,除去Cl2中的水蒸气.
(3)氯气把 SO32-氧化为SO42-,自身被还原为Cl-,反应离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠、水,反应化学方程式为 Cl2+2NaOH=NaCl+NaClO+H2O;检验氯离子的操作为:取少量溶液于试管中,先加HNO3调节pH为酸性,在加AgNO3溶液,如有白色沉淀生成,证明原溶液中有Cl-.
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;取少量溶液于试管中,先加HNO3调节pH为酸性,在加AgNO3溶液,如有白色沉淀生成,证明原溶液中有Cl-.
(5)由题目信息及转化关系可知,B为C3H7ClCOOH,D为C3H7(OH)COOH,E的分子式为C8H12O4,E为环酯,E的核磁共振氢谱显示只有一个峰,分子中含有4个甲基,故A中含有2个甲基,所以B为C(CH3)2ClCOOH,D为C(CH3)2(OH)COOH,所以E的结构简式为

.
故答案为:

.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目