题目内容
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
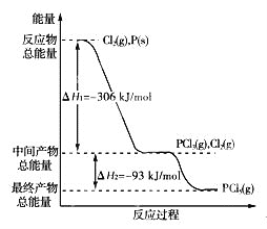
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是________________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是_________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的反应热ΔH3= ___________,P和Cl2一步反应生成1 mol PCl5的ΔH4 ____________ΔH3(填“大于”、“小于”或“等于”);
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是____________________。
【答案】3/2Cl2(g)+P(s)===PCl3(g) ΔH=-306 kJ/mol PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93 kJ/mol -399 kJ/mol 等于 PCl5+4H2O===H3PO4+5HCl
【解析】
根据反应过程与能量的关系图写出热化学方程式以及利用盖斯定律求反应热。
(1)P和Cl2反应生成PCl3的热化学方程式,根据图象,生成气态的PCl3,△H=-306kJ·mol-1。P为固体,Cl2为气体,则热化学方程式为![]() ;
;
(2)从图象来看,PCl3(g)和Cl2(g)生成PCl5(g),△H=-93kJ·mol-1。现在要求PCl5(g)分解成PCl3(g)和Cl2(g),△H应为+93kJ·mol-1。则热化学方程式为PCl5(g)=PCl3(g)+Cl2(g) ΔH=+93 kJ/mol;
(3)P和Cl2分两步反应生成1 mol PCl5的反应热,从图象来看,ΔH3=ΔH1+ΔH2=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol。化学反应热△H只和反应物、生成物的能量有关,与反应路径无关,只要反应物和生成物一样,不管是经过一步还是二步反应,反应热相同,因此ΔH4 等于ΔH3。
(4) PCl5与足量水充分反应,最终生成两种酸,为水解反应,P和Cl的化合价都不变,P为+5价,得到的酸为磷酸,Cl为-1价,得到的酸为HCl。方程式为PCl5+4H2O=H3PO4+5HCl。

 阅读快车系列答案
阅读快车系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c