题目内容
甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:(1)制备合成气:CH4+H2O(g)?CO+3H2.为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO2+H2=CO+H2O.为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为______.
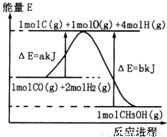
(2)合成甲醇:①反应过程中物质能量变化如右图所示.写出合成甲醇的热化学方程式______.
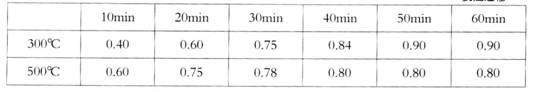
实验室在1L密闭容器中进行模拟合成实验.将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
| 10min | 20min | 30min | 40min | 50min | 60min | |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
③500℃时平衡常数K的数值为______.
④300℃时,将容器的容积压缩到原来的
 ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母).a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加d.重新平衡时c(H2)/c(CH3OH)减小.
【答案】分析:(1)①CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH;
(2)①由图可知合成甲醇的反应热△H=(a-b)kJ/mol,注明物质的状态书写热化学反应方程式;
②300℃时反应开始10分钟内,甲醇浓度为0.4mol/L,计算其反应速率,再利用速率之比等于化学计量数之比计算氢气的反应速率;
③500℃时,CO(g)+2H2(g)?CH3OH(g)
开始(mol/L) 1 2 0
转化 0.8 1.6 0.8
平衡 0.2 0.4 0.8
K=生成物浓度幂之积与反应物浓度幂之积的比;
④300℃时,将容器的容积压缩到原来的 ,压强增大,平衡正向移动,以此分析.
,压强增大,平衡正向移动,以此分析.
解答:解:(1)①CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH,所以为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为3:1,
故答案为:3:1;
(2)①由图可知合成甲醇的反应热△H=(a-b)kJ/mol,则热化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol,
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol;
②300℃时反应开始10分钟内,甲醇浓度为0.4mol/L,其反应速率为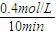 =0.04mol/(L?min),由速率之比等于化学计量数之比可知氢气的反应速率为0.04mol/(L?min)×2=0.08mol/(L?min),故答案为:0.08mol/(L?min);
=0.04mol/(L?min),由速率之比等于化学计量数之比可知氢气的反应速率为0.04mol/(L?min)×2=0.08mol/(L?min),故答案为:0.08mol/(L?min);
③500℃时,CO(g)+2H2(g)?CH3OH(g)
开始(mol/L) 1 2 0
转化 0.8 1.6 0.8
平衡 0.2 0.4 0.8
K= =25,故答案为:25;
=25,故答案为:25;
④300℃时,将容器的容积压缩到原来的 ,压强增大,平衡正向移动,
,压强增大,平衡正向移动,
a.体积缩小,c(H2)增大,故a错误;
b.压强增大,正反应速率加快,逆反应速率也加快,故b错误;
c.平衡正向移动,则CH3OH的物质的量增加,故c正确;
d.平衡正向移动,氢气的物质的量减少,甲醇的物质的量增加,则重新平衡时c(H2)/c(CH3OH)减小,故d正确;
故答案为:c、d.
点评:本题考查化学平衡的计算及影响因素,注重化学反应速率及化学平衡的考查,明确化学反应速率、化学平衡的影响因素是解答的关键,题目难度中等.
(2)①由图可知合成甲醇的反应热△H=(a-b)kJ/mol,注明物质的状态书写热化学反应方程式;
②300℃时反应开始10分钟内,甲醇浓度为0.4mol/L,计算其反应速率,再利用速率之比等于化学计量数之比计算氢气的反应速率;
③500℃时,CO(g)+2H2(g)?CH3OH(g)
开始(mol/L) 1 2 0
转化 0.8 1.6 0.8
平衡 0.2 0.4 0.8
K=生成物浓度幂之积与反应物浓度幂之积的比;
④300℃时,将容器的容积压缩到原来的
 ,压强增大,平衡正向移动,以此分析.
,压强增大,平衡正向移动,以此分析.解答:解:(1)①CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH,所以为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为3:1,
故答案为:3:1;
(2)①由图可知合成甲醇的反应热△H=(a-b)kJ/mol,则热化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol,
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol;
②300℃时反应开始10分钟内,甲醇浓度为0.4mol/L,其反应速率为
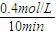 =0.04mol/(L?min),由速率之比等于化学计量数之比可知氢气的反应速率为0.04mol/(L?min)×2=0.08mol/(L?min),故答案为:0.08mol/(L?min);
=0.04mol/(L?min),由速率之比等于化学计量数之比可知氢气的反应速率为0.04mol/(L?min)×2=0.08mol/(L?min),故答案为:0.08mol/(L?min);③500℃时,CO(g)+2H2(g)?CH3OH(g)
开始(mol/L) 1 2 0
转化 0.8 1.6 0.8
平衡 0.2 0.4 0.8
K=
 =25,故答案为:25;
=25,故答案为:25;④300℃时,将容器的容积压缩到原来的
 ,压强增大,平衡正向移动,
,压强增大,平衡正向移动,a.体积缩小,c(H2)增大,故a错误;
b.压强增大,正反应速率加快,逆反应速率也加快,故b错误;
c.平衡正向移动,则CH3OH的物质的量增加,故c正确;
d.平衡正向移动,氢气的物质的量减少,甲醇的物质的量增加,则重新平衡时c(H2)/c(CH3OH)减小,故d正确;
故答案为:c、d.
点评:本题考查化学平衡的计算及影响因素,注重化学反应速率及化学平衡的考查,明确化学反应速率、化学平衡的影响因素是解答的关键,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
 (2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段:
(2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段: 甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:
甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇: CH3OH(g)
CH3OH(g)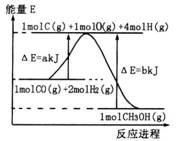
 ②300℃时反应开始10分钟内,H2的平均反应速率为__________。
②300℃时反应开始10分钟内,H2的平均反应速率为__________。