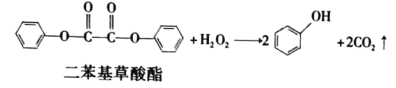
题目内容
【题目】下列合成有机高分子材料的化学方程式和反应类型都正确的是( )
A.nCH2=CH-CN![]()
![]() 加聚反应
加聚反应
B.![]() 缩聚反应
缩聚反应
C.nCH2=CH2+nCH2=CH-CH3![]()
![]() 缩聚反应
缩聚反应
D.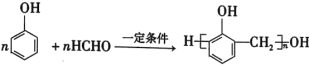 缩聚反应
缩聚反应
【答案】B
【解析】
A.—CN应为支链,碳碳单键可以旋转;
B.乙二酸与乙二醇发生缩聚反应生成高聚物;
C.烯烃发生加聚反应;
D.甲醛与苯酚发生缩聚反应生成高聚物,同时产生水。
A.碳碳单键可以旋转,断开双键的碳原子彼此连接,形成的生成物为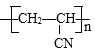 ,A错误;
,A错误;
B.乙二酸与乙二醇发生缩聚反应生成高聚物,反应方程式的书写和反应类型的判断符合反应事实,B正确;
C.烯烃断开双键中较活泼的键,然后这些不饱和碳原子彼此连接形成高聚物,发生的反应类型为加聚反应,不是缩聚反应,C错误;
D.苯酚与甲醛发生缩聚反应形成酚醛树脂和水,反应方程式为n![]() +nHCHO
+nHCHO![]()
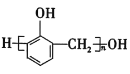 +(n-1)H2O,缺少小分子水,不符合质量守恒定律,D错误;
+(n-1)H2O,缺少小分子水,不符合质量守恒定律,D错误;
故合理选项是B。

 名校课堂系列答案
名校课堂系列答案【题目】FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀 pH | 7.6 | 2.7 |
完全沉淀 pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________。
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
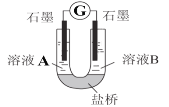
(资料2)原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
(资料3)常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对(资料3)实验事实的解释为____________________。
【题目】烃分子中若含有双键、叁键或环,其碳原子所结合的氢原子则少于同碳原子数对应烷烃所含的氢原子数,亦具有一定的不饱和度![]() 用
用![]() 表示
表示![]() 。下表列出几种烃的不饱和度:
。下表列出几种烃的不饱和度:
有机物 | 乙烯 | 乙炔 | 环己烷 | 苯 |
| 1 | 2 | 1 | 4 |
据此下列说法不正确的是![]()
![]()
A.![]() 的不饱和链烃再结合6molH即达到饱和
的不饱和链烃再结合6molH即达到饱和
B.![]() 的
的![]() 等于6
等于6
C.![]() 与环丁烷的不饱和度相同
与环丁烷的不饱和度相同
D.![]() 的不饱和度与
的不饱和度与![]() 、
、![]() 的不饱和度相同
的不饱和度相同