题目内容
已知有关物质的熔、沸点数据如表1:

请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.不用电解MgO的方法生产镁的原因是________,你认为可以用什么方法生产镁________;不用电解AlCl3的方法生产铝的原因是________.
(2)请设计可靠的实验证明MgCl2,AlCl3所属的晶体类型,其实验方法是________.
(3)AlCl3具有以下________性质(请填序号).
①液化 ②挥发 ③升华
解析:
|
【答案】(1)因为MgO的熔点远高于MgCl2,电解熔融MgO需要较高的温度,损耗较多的能量,电解熔融MgCl2,AlCl3沸点低,易升华;(2)将两种晶体加热到熔融状态,MgCl2能导电,AlCl3不能导电,证明MgCl2为离子晶体,AlCl3为分子晶体;(3)③ 【解析】电解时必须先将反应物熔化,所以物质的熔点较高,会需要较高的温度,损耗较多的能量,对设备、动力的要求都高,不经济.由表中的数据可知,MgO比MgCl2的熔点要高得多,与电解熔融MgCl2相比,电解熔融MgO需要更高的温度,不经济.观察表中数据,可发现AlCl3的熔、沸点较低,且熔点比沸点高,说明AlCl3是分子晶体,且易升华. 离子晶体与其他晶体类型相比,最典型的性质是熔融状态时能导电.可用此性质设计实验,证明晶体类型. 【拓展延伸】各晶体类型结构、性质比较如表2:
通过硬度、熔沸点等性质的数据和大小可判断物质属于哪一种晶体. 活泼金属与活泼非金属形成的化学键一般为离子键,但也有例外,如AlCl3的化学键就不是离子键,而是共价键. |

已知有关物质的熔、沸点数据如表:
|
下图是某工厂对海水资源进行综合利用的示意图.
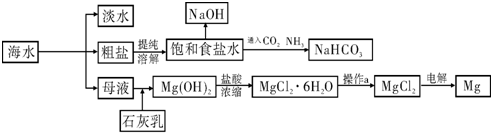
请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点(℃) | 2850 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点(℃) | 3600 | 2980 | 1412 | 182.7 |
工业上常用电解熔融的MgCl2方法生产金属镁,电解Al2O3和冰晶石的熔融体的方法生产铝,为什么不用电解MgO的方法生产镁?也不用电解氯化铝的方法生产铝?
物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105 Pa) |
沸点/℃ | 3600 | 2980 | 1420 | 182.7 |
请参考上述数据,填空和回答下列问题。
(1)工业上用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
(2)设计可靠的实验,证明MgCl2、AlCl3所属的晶体类型,其实验方法是:______________________________。
| MgO | Al2O3 | MgCl2 | AlCl3 |
熔点/ ℃ | 2 852 | 2 072 | 714 | 190(2.5×105Pa) |
沸点/ ℃ | 3 600 | 2 980 | 1 412 | 182.7 |
请参考上述数据完成下列问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是_________________
_____________________________________________________________________。
