题目内容
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________。
(1)①Ⅰ ②< ③80% 250 ℃
(2)CH3OH(l)+O2(g)===CO(g)+2H2O(l)
ΔH=-442.8 kJ·mol-1
【解析】 (1)①反应Ⅰ的产物只有甲醇,而反应Ⅱ的产物有两种,故反应Ⅰ符合“原子经济”原则;②观察图表数据可得,升温时,K值变小,说明该反应的正反应为放热反应,即ΔH1<0;③CO的转化率为(2 mol-0.2 mol·L-1×2 L)/2 mol×100%=80%;此时的化学平衡常数为K=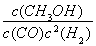 =
=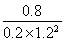 ≈2.041,故此时的温度为250 ℃。(2)将三个热化学方程式进行变形:[①+(-②)+4×③]×
≈2.041,故此时的温度为250 ℃。(2)将三个热化学方程式进行变形:[①+(-②)+4×③]×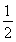 ,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×
,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×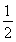 =-442.8 kJ·mol-1。
=-442.8 kJ·mol-1。

25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。

t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=___,从反应开始到第一次平衡时的平均速率v(A)为___。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是__________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。
在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3— (aq)。测得不同温度下该反应的平衡常数K如表所示:
I3— (aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq) I3— (aq)的ΔH>0
I3— (aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3—)减小
C.该反应的平衡常数表达式为K=
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689

