��Ŀ����
��4�֣��ӵ�ʳ���м���ĵ������һ�ְ�ɫ�ᾧ��ĩ�����ܽ�����¶�Ӱ��ܴ������¶ȵ����߶����������º��ȶ��������������µ������һ�ֽ�ǿ��������������⻯��Ȼ�ԭ�����ʷ�����Ӧ��
��1��Ϊ����ijʳ�����Ƿ���KIO3��ijͬѧȡʳ����Ʒ��ȫ�ܽ���ˮ�У�Ȼ������������ữ�ĵ���KI��Һ�������Һ����ɫ����Ӧ�����ӷ���ʽΪ ��
��2��KIO3Ҳ���õ��ķ����Ƶã���ԭ������ʯīΪ�������Բ����Ϊ��������һ���¶Ⱥ͵����µ��KI��Һ���ܷ�Ӧ����ʽΪKI+3H2O=KIO3+3H2�����������ĵ缫��Ӧʽ�ֱ�Ϊ������ ������
��1��5I- + IO3- + 6H+ = 3I2 + 3H2O���������֣�
��2��6H+ + 6e- = 3H2��������I- - 6e- + 6OH-= IO3- + 3H2O ����1�֣�
��������

�ӵ�ʳ���м���ĵ������һ�ְ�ɫ�ᾧ��ĩ�������º��ȶ���������560�濪ʼ�ֽ⡣�����������µ������һ�ֽ�ǿ��������������⻯��������εȻ�ԭ�����ʷ�Ӧ��
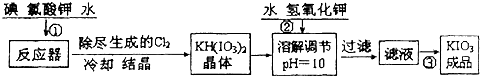
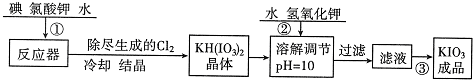
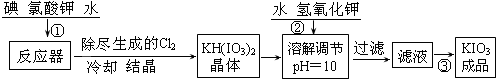
������1����ҵ��������ص��������£�
��1����֪����ٷ�Ӧ�������ķ�Ӧ�У����ɵ����ֻ�ԭ�������õ�������ͬ����д����Ӧ���з�����Ӧ�Ļ�ѧ����ʽ���������� ������������������������������ ����
��2�������±�����ص��ܽ�ȣ������۵õ�����ؾ��壬�㽨��ķ��������� ����
| �¶�/�� | 20 | 40 | 60 | 80 |
| KIO3g/100gˮ | 8.08 | 12.6 | 18.3 | 24.8 |
������2����֪��KIO3��5KI��3H2SO4=3K2SO4��3I2��3H2O�� I2��2S2O32��=2I����S4O62����
��1������ӵ�ʳ���еĵ�Ԫ�أ�ѧ�������õ������⻯�������������·�����Ӧ�������Ȼ�̼����ⵥ��ʱ������������������ ���������� ��
��2���ⶨ�ӵ�ʳ���е�ĺ�����ѧ������Ƶ�ʵ�鲽�����£�
a��ȷ��ȡw gʳ�Σ�����������ˮʹ����ȫ�ܽ⣻
b����ϡ�����ữ������Һ���������KI��Һ��ʹKIO3��KI��Ӧ��ȫ��
c���Ե���Ϊָʾ������μ������ʵ���Ũ��Ϊ2.0��10��3mol/L��Na2S2O3��Һ10.0mL
ǡ�÷�Ӧ��ȫ����ӵ�ʳ����Ʒ�еĵ�Ԫ�غ����� mg/kg���Ժ�w�Ĵ���ʽ��ʾ����
��3��ѧ�����ֶԴ�����NaCl������KIO3������������ʵ�飺
| �������� | ʵ������ |
| ȡ1g������NaCl����3mLˮ�����Һ�� | ��Һ�ޱ仯 |
| ����5�ε�����Һ��1mL 0.1mol/L KI��Һ���� | ��Һ�ޱ仯 |
| Ȼ���ٵ���1��1mol/L��H2SO4���� | ��Һ����ɫ |
�� ���Ʋ�ʵ���в�����ɫ����Ŀ���ԭ�������ӷ���ʽ��ʾ ��
�� ����ѧ������ʵ���������ѧ���ҵ�ʵ����������Ҫ���ۣ� ��