题目内容
人造地球卫星用一种高能电池-银锌电池,该电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,据此判断Ag2O是( )
| A、负极,发生氧化反应 |
| B、正极,发生氧化反应 |
| C、负极,发生还原反应 |
| D、正极,发生还原反应 |
考点:化学电源新型电池
专题:电化学专题
分析:根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,正极上得电子被还原.
解答:
解:根据化合价可知,电极反应中银的化合价降低,被还原;原电池中较活泼的金属做负极,另一电极作正极,发生还原反应,所以氧化银为正极,得电子被还原.
故选D.
故选D.
点评:本题考查原电池知识,题目难度中等,注意原电池两极上的变化以及原电池原理.

练习册系列答案
相关题目
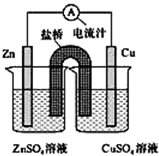 如图为一原电池的装置示意图,下列说法不正确的是( )
如图为一原电池的装置示意图,下列说法不正确的是( )| A、原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| B、原电池工作时,电流由铜极流经电流计流向锌极 |
| C、原电池工作时,盐桥中K+移向CuSO4溶液 |
| D、如果将Cu电极与Zn电极互换,电流计指针反向偏转 |
下列说法中正确的是( )
| A、2mol CH4的质量和O2的摩尔质量都是32g |
| B、1mol任何气体中都含有相同的原子数 |
| C、0.5molNaCl约含有6.02×1023个离子 |
| D、1mol/LKCl溶液中含有溶质1mol |
下列变化必须加还原剂才能发生的是( )
| A、Na2CO3→NaHCO3 | ||
| B、H2O2→H2O | ||
| C、Cu→CuO | ||
D、MnO
|
设NA为阿伏加德罗常数,下列有关说法正确的是( )
| A、0.5mol苯分子中含有C=C双键数为1.5NA | ||
| B、2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | ||
C、标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为
| ||
| D、1 mol甲基(-CH3)所含的电子总数为8 NA |
下列关于摩尔的说法和使用正确的是( )
| A、物质的数量单位 |
| B、物质的量的单位 |
| C、1mol氧 |
| D、1mol大米 |
 右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少量的水(已染成红色).如沿小试管壁小心地慢慢注入3mL浓硫酸,静置片刻后,U型细玻管中可观察到的液面现象是( )
右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少量的水(已染成红色).如沿小试管壁小心地慢慢注入3mL浓硫酸,静置片刻后,U型细玻管中可观察到的液面现象是( )| A、左高右低 | B、左低右高 |
| C、左右一样高 | D、来回振动 |
下列与化学反应能量相关的叙述正确的是( )
| A、反应物的总能量一定高于生成物的总能量 |
| B、一个反应是放热还是吸热取决于该反应的发生是否需要加热 |
| C、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 |
| D、若旧键断裂吸收的总能量小于新键形成放出的总能量,则该反应为吸热反应 |
下列物质在水溶液中的电离方程式正确的是( )
| A、NaHSO4═Na++H++SO42- |
| B、KClO3═K++Cl5++3O2- |
| C、Ba(OH)2═Ba2++(OH)22- |
| D、H2SO4═H2++SO42- |