题目内容
在室温下,0.1 mol·L-1CH3COONa溶液的pH=8,试精确表达下列算式的数学结果(填具体数字):
⑴c (Na+) -c (CH3COO-)=________mol·L-1;
⑵c (OH-) -c (CH3COOH)=________mol·L-1
9.9×10-7 10-8
.1 mol·L-1CH3COONa溶液的pH=8,则c (Na+)=0.1mol/L,c (H+)=10-8mol/L,所以c (OH-)=10-6mol/L.根据电荷守恒可知c (Na+) -c (CH3COO-)= c (OH-)-c (H+)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L;根据质子守恒可知c (OH-) -c (CH3COOH)= c (H+)=10-8mol/L。
.1 mol·L-1CH3COONa溶液的pH=8,则c (Na+)=0.1mol/L,c (H+)=10-8mol/L,所以c (OH-)=10-6mol/L.根据电荷守恒可知c (Na+) -c (CH3COO-)= c (OH-)-c (H+)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L;根据质子守恒可知c (OH-) -c (CH3COOH)= c (H+)=10-8mol/L。

练习册系列答案
相关题目
已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
|
|
I1 |
I2 |
I3 |
I4 |
|
电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
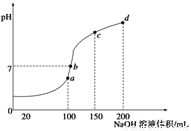
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。



