题目内容
(1)某研究性学习小组设计了如图1所示装置探究钢铁的腐蚀与防护.
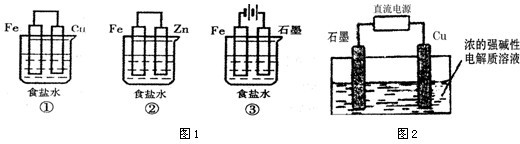
在相同条件下,三组装置中铁电极腐蚀最快的是
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车.电池反应为FePO4+Li
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电.该电池放电时Li+向
(3)Cu2O是一种半导体材料,可通过如图2的电解装置制取,电解总反应为:2Cu+H2O
Cu2O+H2.阴极的电极反应式是

在相同条件下,三组装置中铁电极腐蚀最快的是
①
①
(填装置序号),该装置中正极电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;为防止金属Fe被腐蚀,可以采用上述②③
②③
(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为2Cl-+2H2O
2OH-+Cl2↑+H2↑
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑
.
| ||
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车.电池反应为FePO4+Li
| 放电 |
| 充电 |
正
正
极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为FePO4+Li++e-=LiFePO4
FePO4+Li++e-=LiFePO4
.(3)Cu2O是一种半导体材料,可通过如图2的电解装置制取,电解总反应为:2Cu+H2O
| ||
2H++2e-=H2
2H++2e-=H2
.若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为7.2
7.2
g.分析:(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;
(2)原电池中阳离子移向正极;依据总反应方程式和负极电极反应计算得到正极电极反应式;
(3)图2所示的电解装置,发生2Cu+H2O
Cu2O+H2,阴极氢离子得电子生成氢气,用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时利用电子守恒可知,4H+~Cu2O.
(2)原电池中阳离子移向正极;依据总反应方程式和负极电极反应计算得到正极电极反应式;
(3)图2所示的电解装置,发生2Cu+H2O
| ||
解答:解:(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;所以①组装置中铁电极腐蚀最快;正极反应是氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;②③装置中铁被保护装置③中发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子发生还原反应,反应离子方程式为:2Cl-+2H2O
H2↑+Cl2↑+2OH-,
故答案为:①;O2+2H2O+4e-=4OH-;②③; 2Cl-+2H2O
H2↑+Cl2↑+2OH-;
(2)FePO4+Li
LiFePO4 放电过程是原电池,总反应方程式减去负极反应得到正极电极反应为FePO4+Li++e-=LiFePO4,
故答案为:正;FePO4+Li++e-=LiFePO4;
(7)图2所示的电解装置,发生2Cu+H2O
Cu2O+H2,阴极氢离子得电子生成氢气,电极反应为2H++2e-=H2,用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时利用电子守恒可知,4H+~Cu2O,则Cu2O的理论产量为
×144g/mol=7.2g,故答案为:2H++2e-=H2;7.2.
| ||
故答案为:①;O2+2H2O+4e-=4OH-;②③; 2Cl-+2H2O
| ||
(2)FePO4+Li
| 放电 |
| 充电 |
故答案为:正;FePO4+Li++e-=LiFePO4;
(7)图2所示的电解装置,发生2Cu+H2O
| ||
| 0.2mol |
| 4 |
点评:本题考查了金属腐蚀与防护的方法和应用,原电池电极反应书写方法,电解池反应离子方程式的书写应用,明确计算中的电子守恒及电极反应,题目难度中等.

练习册系列答案
相关题目