题目内容
10.某原电池反应的离子方程式为Fe+2H+═Fe2++H2↑,则下列说法正确的是( )| A. | 稀硝酸为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 铁极质量不变 | D. | 铜为原电池正极 |
分析 原电池反应的离子方程式为:Fe+2H+═Fe2++H2↑,则负极为Fe,正极为比Fe不活泼的金属或惰性电极,电解质为HCl或H2SO4,原电池中电子由负极流向正极,以此来解答.
解答 解:由电池反应的离子方程式知,电池的负极为铁,则正极应是比铁不活泼的金属(B项不正确),
A、由于反应中放出了氢气并生成了Fe2+,故知电解质溶液不能是HNO3,故A错误;
B、锌比铁活泼,所以如果锌做电极,锌是负极,故B错误;
C、在反应中负极不断被消耗,故C错误;
D、根据原电池反应,则负极为Fe,正极为比Fe不活泼的金属或惰性电极,如金属铜,故D正确.
故选D.
点评 本题考查原电池,明确原电池的工作原理及电极材料、电解质的选择是解答本题的关键,注意硝酸具有强氧化性,题目难度不大.

练习册系列答案
相关题目
18.下列微粒结构示意图错误的是( )
| A. | 14C: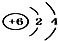 | B. | 16O: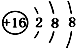 | C. | Li+: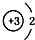 | D. | H-: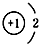 |
5.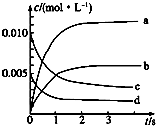 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)如图表示NO2的浓度变化的曲线是b.用O2表示从0~2s内该反应的平衡速率v=1.5×10-3mol•L-1•s-1.
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
15.在下列关于新型有机高分子材料的说法中,不正确的是( )
| A. | 高分子分离膜应用于食品工业中,可用来浓缩天然果汁、乳制品加工、酿造业等 | |
| B. | 复合材料一般是以一种材料做基体,另一种材料作为增强剂 | |
| C. | 合成高分子材料制成的人工器官一般都受到人体的排斥,难以达到生物相容的程度 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
2.下列反应的离子方程式正确的是( )
| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入适量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 电镀铜时阳极反应为:Cu2++2e-=Cu |
19.下列各组物质沸点大小关系正确的是( )
①CH3CH2CH2OH>CH3(CH2)2CH3
②CH3(CH2)2CH3>CH3CH(CH3)2
③苯酚>苯
④CH3CH2Br>CH3CH2OH
⑤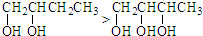
①CH3CH2CH2OH>CH3(CH2)2CH3
②CH3(CH2)2CH3>CH3CH(CH3)2
③苯酚>苯
④CH3CH2Br>CH3CH2OH
⑤
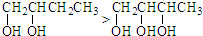
| A. | ①④ | B. | ②④⑤ | C. | ①②③ | D. | ③④⑤ |
20.下列有关化学实验的叙述正确的是( )
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 常温下,某同学用pH试纸测得KCl溶液的pH约为7.0 | |
| C. | 配制Fe2(SO4)3溶液时,先把Fe2(SO4)3晶体溶于浓硫酸后稀释 | |
| D. | 用碱式滴定管准确移取KMnO4溶液,体积为21.50mL |
 .
. .
.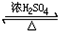 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.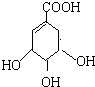 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图: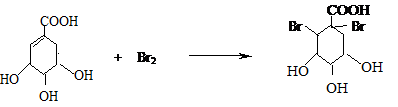 .
.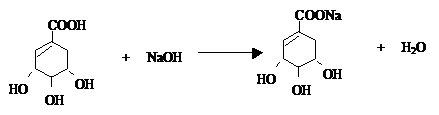 .
.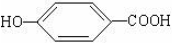 ),其反应类型消去反应.
),其反应类型消去反应.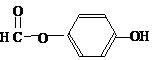 或
或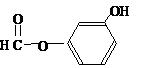 或
或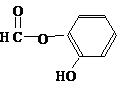 .
.