题目内容
海水中镁的总储量约为1.8×1015吨,而目前世界上利用的镁60%来自海水。如图是海水提取镁的工艺流程图。
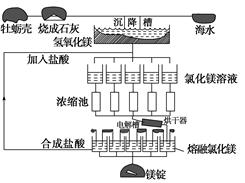
根据上面的图示,回答下列问题:
(1)请写出海水提取镁的工艺流程中属于分解反应的一个化学方程式:
________________________________________________________________________。
(2)工业上采用电解熔融MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为:
________________________________________________________________________。
(3)上述制备镁的工艺流程中,适合循环经济的做法是
________________________________________________________________________。
(4)工业上制取金属铝时用电解__________(填原料)的方法,试解释铝电解槽中的阳极碳棒为何要定期更换?
________________________________________________________________________
________________________________________________________________________。
(1)CaCO3 CaO+CO2↑(或MgCl2(熔融)
CaO+CO2↑(或MgCl2(熔融) Mg+Cl2↑) (2)Mg2++2e-===Mg
Mg+Cl2↑) (2)Mg2++2e-===Mg
(3)海边牡蛎壳(贝壳)的利用、盐酸的循环使用(答一条即可)
(4)熔融Al2O3和冰晶石 阳极产生的氧气与阳极材料中的碳棒发生反应,而使阳极碳棒不断地被消耗
【解析】
试题分析:(1)用牡蛎壳(贝壳)烧制石灰属于分解反应,电解熔融氯化镁属于分解反应。
(2)电解反应中,阴极发生还原反应,电解熔融氯化镁时阴极镁离子得电子,生成单质镁。
(3)在生产工艺中,能够循环使用,对环境有利的做法都是循环经济。该工艺中海边贝壳的使用,属于因地制宜、废物利用;盐酸的循环使用也体现了这一思想。
(4)工业冶炼铝用的是熔融的氧化铝和冰晶石,而不是氯化铝;电解时阳极产生氧气,氧气能够与该阳极材料碳棒反应,造成消耗,因此要定期更换。
考点:考查海水中镁的提纯的有关判断和计算、电极反应式的书写
点评:该题是高考中的常见题型,试题基础性强,难易适中,属于中等难度的试题。该题有利于培养学生分析问题、解决问题的能力。有利于培养学生的规范答题能力,增强学生的能源危机意识,引导学生树立厉行节约的习惯。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
