题目内容
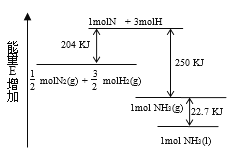
【题目】煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)![]() CaO(s) + CO2(g) △H1= +178.30kJ/mol
CaO(s) + CO2(g) △H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)![]() CaSO4(s) △H2= -501.92 kJ/mol
CaSO4(s) △H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g) ![]() CO2(g) △H3
CO2(g) △H3
④CaSO4(s) + CO(g) ![]() CaO(s) + SO2(g) + CO2(g) △H4= +218.92kJ/mol
CaO(s) + SO2(g) + CO2(g) △H4= +218.92kJ/mol
(1)温度升高,反应①的化学平衡常数________(填“增大”“减小”或“不变”)。
(2)△H3=________kJ/mol。
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:________。
【答案】增大 -283 鼓入稍过量的空气,增大了反应体系中氧气的浓度,使反应②平衡正向移动,有利于固硫;同时,氧气浓度增大也会使反应③平衡正向移动,降低CO浓度,增大CO2浓度,使反应④平衡逆向移动,(或其他合理分析)有利于固硫
【解析】
(1)反应①正反应吸热,温度升高,平衡正向移动;
(2)根据盖斯定律计算△H3;
(3)根据增大氧气浓度后,平衡移动方向分析。
(1)反应①正反应吸热,温度升高,平衡正向移动,化学平衡常数增大;
(2)②CaO(s) + SO2(g) + 0.5O2(g)![]() CaSO4(s) △H2= -501.92 kJ/mol
CaSO4(s) △H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g) ![]() CO2(g) △H3
CO2(g) △H3
④CaSO4(s) + CO(g) ![]() CaO(s) + SO2(g) + CO2(g) △H4= +218.92kJ/mol
CaO(s) + SO2(g) + CO2(g) △H4= +218.92kJ/mol
根据盖斯定律④+②得CO(g) + 0.5O2(g) ![]() CO2(g) △H3=+218.92kJ/mol-501.92 kJ/mol=-283 kJ/mol;
CO2(g) △H3=+218.92kJ/mol-501.92 kJ/mol=-283 kJ/mol;
(3)鼓入稍过量的空气,增大了反应体系中氧气的浓度,使反应②平衡正向移动,有利于固硫;同时,氧气浓度增大也会使反应③平衡正向移动,降低CO浓度,增大CO2浓度,使反应④平衡逆向移动,有利于固硫。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】过氧化钙可用于治理赤潮、应急供氧等。已知:过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢。某小组同学探究过氧化钙的制法和性质:
(1)甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是______(填A、B)
方法A Ca (OH)2 (s) + H2O2 CaO2 (s) + 2H2O
方法B CaCl2 (s) + H2O2 CaO2 (s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是 ___________(填化学式)
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是______________。
(2)丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:
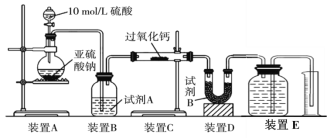
①试剂B的作用是____________________。
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:______________________________。
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =______。
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:
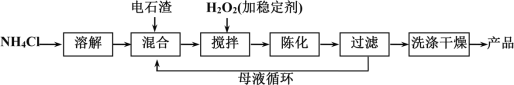
用上述方法制备过氧化钙(CaO2·8H2O),搅拌步骤的化学方程式是______________。
②某小组釆用单变量法确定温度、H2O2浓度对产率的影响,结果如下,则实际生产应选择的适宜条件为__________。
H2O2 % | 30% | 25% | 20% | 15% | 10% | 5% | ||||||
产率 | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 | ||||||
温度(℃) | 50 | 40 | 30 | 20 | 10 | 0 | ||||||
产率 | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 | ||||||
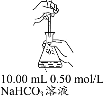
【题目】向10.00 mL 0.50 mol/L NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
实验 | 序号 | c(CaCl2)(mol·L-1) | 滴加CaCl2溶液时的 实验现象 | 加热浑浊液时的 实验现象 |
| ① | 0.05 | 至1.32 mL时产生明显浑浊,但无气泡产生 | 有较多气泡生成 |
② | 0.005 | 至15.60 mL时产生明显浑浊,但无气泡产生 | 有少量气泡生成 | |
③ | 0.0005 | 至20 mL未见浑浊 |
A.①中产生浑浊的原因是c(Ca2+)·c(CO32)>Ksp(CaCO3)
B.未加热前①和②中发生了反应:2HCO3-+Ca2+=CaCO3↓+H2CO3
C.加热浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2
D.向上述NaHCO3溶液中加入足量0.5 mol/LCaCl2溶液,可能同时产生浑浊和气泡
【题目】在3个体积均为2.0 L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.28 | 0.56 | 0 | 0.4 |
II | 977 | 0.56 | 0.56 | 0 | x |
III | 1250 | 0 | 0 | 0.56 | y |
A.977K,该反应的化学平衡常数值为2
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器Ⅰ中CO2的转化率比容器Ⅱ中的大
D.达到平衡时,容器Ⅲ中的CO的转化率大于28.6%