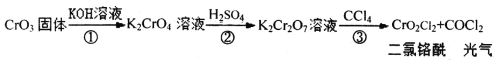
题目内容
【题目】第三周期元素X、Y、Z、W的最高价氧化物分别溶于水得溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是( )
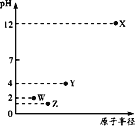
A.Y可能是硅元素
B.简单离子半径:Z>W>X
C.气态氢化物的稳定性:Y>W
D.非金属性:Y>Z
【答案】B
【解析】
第三周期元素中,X最高价氧化物水化物的溶液的pH为12,氢氧根浓度为0.01mol/L,故为一元强碱,则X为Na,Y、W、Z对应的最高价氧化物水化物的溶液pH均小于7,均为酸,W最高价含氧酸溶液中氢离子浓度为0.01mol/L,故为一元强酸,则W为Cl元素;等浓度的最高价含氧酸中,Z电离出氢离子浓度比W的大、Y对应的酸性最弱,而原子半径Y>Z>Cl,故Z为S元素,Y为P元素,以此来解答。
由上述分析可知,X为Na、Y为P、Z为S,W为Cl,
A.Y不可能是Si元素,因为SiO2不溶于水,由分析可知Y是P元素,故A错误;
B.电子层越多,离子半径越大,具有相同排布的离子中原子序数大的离子半径小,则S2-、Cl-和Na+的离子半径为S2->Cl->Na+,故B正确;
C.Cl的非金属性比P强,则气态氢化物的稳定性HCl>PH3,故C错误;
D.S和P是同周期的主族元素,核电荷数大,元素的非金属性强,即S的非金属性大于P,故D错误;
故答案为B。

【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4 ①
R-OH+HBr![]() R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答:
(1)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是___(填字母)。
a.分液 b.蒸馏 c.萃取 d.过滤
(2)溴乙烷的水溶性___乙醇(填“大于”、“等于”或“小于”),其原因是___。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在___(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是___(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)为了检验溴乙烷中含有溴元素,通常采用的方法是:取少量溴乙烷,然后进行下列操作:①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液。下列操作顺序合理的是___(填字母)。
a.①②③④ b.②③①④ c.④①③② d. ①④②③
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___。