题目内容
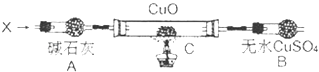
【题目】2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一. 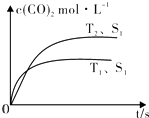
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式 .
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 .
A.容器中密度不变 B.单位时间内消耗2molCO2 , 同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3 D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)
在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线 .
(3)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为 .
(4)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧实验中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= .
(5)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入KOH电解质溶液中,其电池反应为 4NH3+3O2=2N2+6H2O,写出该燃料电池的正极反应式 .
【答案】
(1)![]() ;BD
;BD
(2)<;
(3)<;45%
(4)![]()
(5)O2+2H2O+4e﹣=4OH﹣
【解析】解:(1)①化学平衡常数K= ![]() ,所以答案是:
,所以答案是: ![]() ;②A.容器中气体质量不变、容器体积不变,所以容器中密度始终不变,则不能根据密度判断平衡状态,故错误; B.单位时间内消耗2molCO2 , 同时消耗1mol二甲醚也同时生成1mol二甲醚,二甲醚正逆反应速率相等,该反应达到平衡状态,故正确;C.无论反应是否达到平衡状态都存在v(CO2):v(H2)=1:3,所以不能据此判断平衡状态,故错误;D.反应前后气体物质的量之和减小,所以反应前后气体压强改变,当容器内压强保持不变时,该反应达到平衡状态,故正确;故选BD;
;②A.容器中气体质量不变、容器体积不变,所以容器中密度始终不变,则不能根据密度判断平衡状态,故错误; B.单位时间内消耗2molCO2 , 同时消耗1mol二甲醚也同时生成1mol二甲醚,二甲醚正逆反应速率相等,该反应达到平衡状态,故正确;C.无论反应是否达到平衡状态都存在v(CO2):v(H2)=1:3,所以不能据此判断平衡状态,故错误;D.反应前后气体物质的量之和减小,所以反应前后气体压强改变,当容器内压强保持不变时,该反应达到平衡状态,故正确;故选BD;
(2.)①根据先拐先平数值大知,T1>T2,升高温度,二氧化碳浓度降低,说明正反应是放热反应,则焓变小于0,所以答案是:<;②催化剂只改变反应速率不改变平衡移动,所以平衡时二氧化碳浓度不变,但反应到达平衡的时间缩短,其图象为  ,所以答案是:
,所以答案是:  ;
;
(3.)①该反应的浓度商= ![]() =12.5>K,平衡逆向移动,则正反应速率小于逆反应速率,所以答案是:<;②根据表中数据知,20min时该反应达到平衡状态,恒温恒容条件下,反应前后气体物质的量之比等于其压强之比,反应后压强是反应前的0.70倍,则反应后气体物质的量=0.70×(1+2)mol=2.1mol,根据方程式知,参加反应的n(CO)为反应前后气体减少物质的量的一半,所以参加反应的n(CO)=(1+2﹣2.1)mol×
=12.5>K,平衡逆向移动,则正反应速率小于逆反应速率,所以答案是:<;②根据表中数据知,20min时该反应达到平衡状态,恒温恒容条件下,反应前后气体物质的量之比等于其压强之比,反应后压强是反应前的0.70倍,则反应后气体物质的量=0.70×(1+2)mol=2.1mol,根据方程式知,参加反应的n(CO)为反应前后气体减少物质的量的一半,所以参加反应的n(CO)=(1+2﹣2.1)mol× ![]() =0.45mol,所以CO转化率=
=0.45mol,所以CO转化率= ![]() =45%,
=45%,
所以答案是:45%;
(4.)由反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3③则反应 ![]() 可得到反应①,则△H1=
可得到反应①,则△H1= ![]() ,所以答案是:△H1=
,所以答案是:△H1= ![]() ;
;
(5.)燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e﹣=4OH﹣ , 所以答案是:O2+2H2O+4e﹣=4OH﹣ .
【考点精析】关于本题考查的化学平衡常数的含义和化学平衡状态的判断,需要了解指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态;状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能得出正确答案.

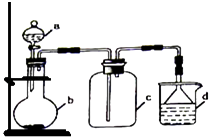
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 氯化铵 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A.A
B.B
C.C
D.D