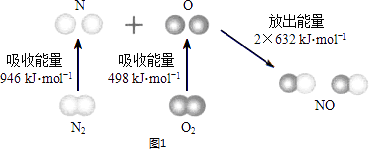
题目内容
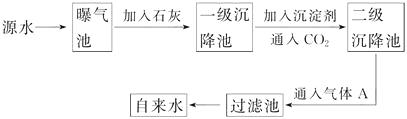
【题目】海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图: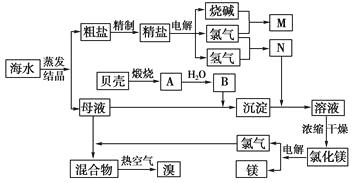
请回答:
(1)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为。
A.蒸馏
B.灼烧
C.过滤
D.蒸发
E.冷却结晶
(2)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是。
(3)目前工业上主要采用隔膜法电解饱和食盐水,下列关于隔膜电解槽的叙述错误的是________。
A.隔膜的作用是防止氯气和氢氧化钠、氯气和氢气接触而发生反应
B.电解之前应除去Ca2+、Mg2+以防止电解时生成Ca(OH)2、Mg(OH)2堵塞隔膜
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(4)母液中常含有MgCl2、NaCl、MgSO4 , KCl等,可进一步加工制得一些重要的产品。若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的晶体。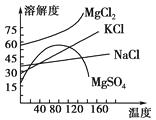
【答案】
(1)D、E、C
(2)在HCl气流中脱水,防止MgCl2水解
(3)D
(4)MgSO4、NaCl;KCl
【解析】(1)由溶液中提纯易溶于水的晶体,常用蒸发、冷却结晶的方法。(2)MgCl2·6H2O制无水氯化镁,如果直接加热MgCl2·6H2O不能得到,应将MgCl2·6H2O在干燥的HCl气流中加热得无水MgCl2。(3)隔膜法电解槽的阳极用碳棒制成,阴极为铁网,所以D错误。(4)将母液加热升温到60℃以上,由图象可知MgSO4的溶解度随着温度的升高而降低,所以随着水分的蒸发,会有MgSO4晶体和氯化钠析出,然后将滤液降温到30℃以下,又逐渐析出KCl晶体。

 口算能手系列答案
口算能手系列答案