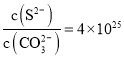题目内容
【题目】工业上用软锰矿(主要成分为MnO2,含有少量的SiO2和FeS2杂质)为原料制取高纯MnO2,其工艺流程如下:

回答下列问题:
(1)步骤①将软锰矿研磨成细粉的主要目的是________;步骤②酸浸取时,主要产物有S、MnSO4及Fe2(SO4)3,写出反应的化学方程式:________。
(2)滤渣Ⅰ的主要成分是________。
(3)步骤④加入氨水调节pH=4,过滤后的滤液中,c(Fe3+)=________mol/L。{已知Ksp[Fe(OH)3]=1×10-38}
(4)步骤⑤所得的滤渣Ⅱ可用于制备铁红,该反应的化学方程式为________。

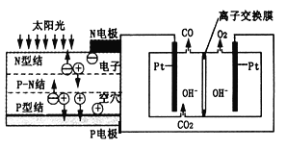
(5)步骤⑥电解MnSO4酸性溶液,原理如图所示。阳极产生MnO2,其电极反应式为________;阴极产生的气体为________(写化学式)。
【答案】增大接触面积,提高硫酸浸取时的浸取率及反应速率 3MnO2+2FeS2+6H2SO4=3MnSO4+Fe2(SO4)3+4S+6H2O S、SiO2 1×10-8 2Fe(OH)3![]() Fe2O3+3H2O Mn2++2H2O-2e-=MnO2+4H+ H2
Fe2O3+3H2O Mn2++2H2O-2e-=MnO2+4H+ H2
【解析】
(1)将软锰矿磨成细粉,可提高浸取率;MnO2和FeS2与硫酸反应生成S、MnSO4及Fe2(SO4)3;
(2)S、SiO2不与硫酸反应;
(3)根据Ksp[Fe(OH)3]计算;
(4)滤渣Ⅱ为Fe(OH)3,受热分解得到Fe2O3;
(5)阳极发生氧化反应,MnSO4失去电子产生MnO2;阴极由氢离子得电子生成氢气。
(1)为了提高浸取率,将软锰矿磨成细粉,主要目的是:增大接触面积,提高硫酸浸取时的浸取率及反应速率;MnO2和FeS2与硫酸反应生成S、MnSO4及Fe2(SO4)3,则化学方程式为3MnO2+2FeS2+6H2SO4=3MnSO4+Fe2(SO4)3+4S+6H2O;
(2)S、SiO2不与硫酸反应,最后以沉淀的形式分离出来;
(3)pH=4时,c(OH-)=10-10mol/L,c(Fe3+)=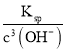 =
=![]() =1×10-8mol/L;
=1×10-8mol/L;
(4)步骤⑤所得的滤渣Ⅱ为Fe(OH)3,受热分解,得到Fe2O3,则化学方程式为:2Fe(OH)3Fe2O3+3H2O;
(5)阳极发生氧化反应,MnSO4失去电子产生MnO2,电极反应式为:Mn2++2H2O-2e-=MnO2+4H+;阴极由氢离子得电子生成氢气。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案