��Ŀ����
����Ŀ���Իش����и��⣺ 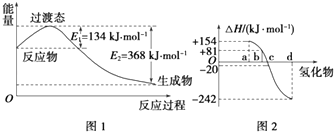
��1����ͼ1��ʾ��NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��
��2����ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йأ�
����֪��H2��g��+Cl2��g���T2HCl��g����H=��185kJmol��1
����գ�
���ۼ� | H��H | Cl��Cl | H��Cl |
����/��kJmol��1�� | 436 | 247 |
��ͼ2�б�ʾ����Ԫ���������������������⻯��ʱ���ʱ����ݣ������ʱ����ݿ�ȷ��a��b��c��d�ֱ��������Ԫ�أ���д��������������ѧ��״̬�£������ֽⷴӦ���Ȼ�ѧ����ʽ�� ��
��3����֪��Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H=��25kJmol��1��
3Fe2O3��s��+CO��g���T2Fe3O4��s��+CO2��g����H=��47kJmol��1��
Fe3O4��s��+CO��g���T3FeO��s��+CO2��g����H=+19kJmol��1��
��д��CO��ԭFeO���Ȼ�ѧ����ʽ��
���𰸡�
��1��NO2��g��+CO��g���TNO��g��+CO2��g����H=��234 kJ?mol��1
��2��434��H2Se��g���TSe��s��+H2��g����H=��81 kJ?mol��1
��3��CO��g��+FeO��s���TFe��s��+CO2��g����H=��11 kJ?mol��1
���������⣺��1����ͼ��֪��1mol NO2��1mol CO��Ӧ����CO2��NO�ų�����368��134=234kJ����Ӧ�Ȼ�ѧ����ʽΪNO2��g��+CO��g��=NO��g��+CO2��g����H=��234 kJmol��1 �� ���Դ��ǣ�NO2��g��+CO��g��=NO��g��+CO2��g����H=��234 kJmol��1����2���١�H=436kJ/mol+247kJ/mol��2E��H��Cl��=��185kJ/mol����ã�E��H��Cl��=434kJ/mol��
���Դ��ǣ�434��
�ڷǽ���Ԫ���⻯����ȶ���������1mol�⻯��ʱ�ġ�H�Ĺ�ϵΪ������Ԫ�������ɣ�ͬһ����Ԫ�طǽ�����Խǿ��������̬�⻯��Խ���ף���̬�⻯��Խ�ȶ���������Խ��Խ�ȶ�������a��b��c��d����Ϊ��H2Te��H2Se��H2S��H2O��
bΪ����������������ݣ���������ֽ����ȣ���H=��81kJ/mol������H2Se�����ֽⷴӦ���Ȼ�ѧ��Ӧ����ʽΪ��H2Se��g��=Se��s��+H2��g����H=��81kJ/mol��
���Դ��ǣ�H2Se��g��=Se��s��+H2��g����H=��81kJ/mol����3����Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H=��25kJ/mol��
��3Fe2O3��s��+CO��g���T2Fe3O4��s��+CO2��g����H=��47kJ/mol��
��Fe3O4��s��+CO��g���T3FeO��s��+CO2��g����H=+19kJ/mol��
���ݸ�˹���ɣ�3���٩��ک�2���ۣ��� ![]() �ã�Fe��s��+CO��g���TFe��s��+CO2��g����H=
�ã�Fe��s��+CO��g���TFe��s��+CO2��g����H= ![]() =��11KJ/mol��
=��11KJ/mol��
���Դ��ǣ�FeO��s��+CO��g���TFe��s��+CO2��g����H=��11kJ/mol��
�����㾫����������Ĺؼ��������ⷴӦ�Ⱥ��ʱ�����֪ʶ�������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�

 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�����Ŀ��������Ԫ��A��B��C��D�����ڱ��е�λ����ͼ��ʾ��B��D����������֮��Ϊ12�����߿��γ�DB2��DB3���ַ��ӣ�DB2����Ư���ԣ�
A | B | |
C | D |
�ش��������⣺
��1��Aλ��Ԫ�����ڱ����ڣ��壬���⻯��ķ���ʽ�� ��
��2�����������У���ȷ����������ĸ����
a���ȶ��ԣ�A���⻯�C���⻯�� b����ԭ�ԣ�B2����D2��
c�����ԣ�H4CO4��H2DO4 d������ϼ�ֵ��D=B��A��C
��3��DB2ͨ�����й������̿��ƻ���ҵԭ��H2DB4�������ԴH2 �� 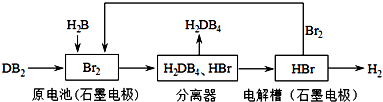
��ԭ�����DB2���뷴Ӧ�ĵ缫Ϊ �� д���缫��Ӧʽ������5mol DB2�μӷ�Ӧ��������Ӧ������ģ��������ɱ�״����L H2 ��
��Ϊ����������ķ���Ч����ȡ������H2DB4��Һ���Թܣ���������μ���AgNO3��Һ����ַ�Ӧ�����۲쵽 �� ֤������Ч���Ϻã�
�۽��ù����������ܷ�Ӧ�Ļ�ѧ����ʽ��ʾΪ��