题目内容
 三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化.已知B分子组成中z原子个数比C分子中少一个.
三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化.已知B分子组成中z原子个数比C分子中少一个.请回答下列问题:
(1)元素x的原子结构示意图
(2)已知C的浓溶液与浓盐酸相遇可产生白烟,写出白烟成份的电子式:
(3)C与X在一定条件下生成化合物A的化学方程式:
(4)一定条件下,A与C反应可生成Y和B,请写出该反应的化学方程式;并用单线桥法标出电子转移的方向与数目.
(5)用电子式表示B的形成过程
考点:无机物的推断
专题:推断题
分析:三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,则这三种气体是氮气、氧气和氢气(稀有气体除外),生成的三种化合物有NO、H2O、NH3,B分子组成中z原子个数比C分子中少一个,比较这三种分子知,只有水分子中的H原子比氨气分子中的氢原子少一个,所以z为H元素,A分子为NO,B分子为H2O,C分子为NH3,所以Y是N元素,X为O元素,结合物质的结构性质解答.
解答:
解:三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,则这三种气体是氮气、氧气和氢气(稀有气体除外),生成的三种化合物有NO、H2O、NH3,B分子组成中z原子个数比C分子中少一个,比较这三种分子知,只有水分子中的H原子比氨气分子中的氢原子少一个,所以z为H元素,A分子为NO,B分子为H2O,C分子为NH3,所以Y是N元素,X为O元素,
(1)x为O元素,氧原子核外有2个电子层,最外层电子数是6,原子结构示意图为 ,y是N元素,氮原子核外有2个电子层,最外层有5个电子,位于第二周期ⅤA族,
,y是N元素,氮原子核外有2个电子层,最外层有5个电子,位于第二周期ⅤA族,
故答案为: ;第二周期ⅤA族;
;第二周期ⅤA族;
(2)C的浓溶液与浓盐酸相遇可产生白烟,白烟成份为NH4Cl,其电子式为: ,
,
故答案为: ;
;
(3)C与X在一定条件下生成化合物A的化学方程式为:4NH3+5O2
4NO+6 H2O,
故答案为:4NH3+5O2
4NO+6 H2O;
(4)一定条件下,A与C反应可生成Y和B,请写出该反应的化学方程式;并用单线桥法标出电子转移的方向与数目为: ,
,
故答案为: ;
;
(5)两个氢原子和氧原子共用电子对而形成共价键,其形成过程为: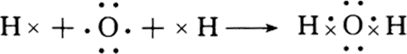 ,
,
故答案为: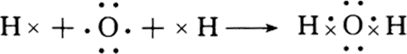 .
.
(1)x为O元素,氧原子核外有2个电子层,最外层电子数是6,原子结构示意图为
 ,y是N元素,氮原子核外有2个电子层,最外层有5个电子,位于第二周期ⅤA族,
,y是N元素,氮原子核外有2个电子层,最外层有5个电子,位于第二周期ⅤA族,故答案为:
 ;第二周期ⅤA族;
;第二周期ⅤA族;(2)C的浓溶液与浓盐酸相遇可产生白烟,白烟成份为NH4Cl,其电子式为:
 ,
,故答案为:
 ;
;(3)C与X在一定条件下生成化合物A的化学方程式为:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(4)一定条件下,A与C反应可生成Y和B,请写出该反应的化学方程式;并用单线桥法标出电子转移的方向与数目为:
 ,
,故答案为:
 ;
;(5)两个氢原子和氧原子共用电子对而形成共价键,其形成过程为:
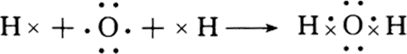 ,
,故答案为:
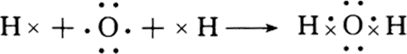 .
.
点评:本题考查了元素、物质的推断,以“B分子组成中Z原子个数比C分子中少一个”为题眼进行推断,结合物质的化学式来分析解答,题目难度中等.

练习册系列答案
相关题目
2002年由德、法、英、美及波兰多国科学家组成的科研小组,通过离子加速器进行了一周的实验,获得了6个罕见的45Fe原子.接着科学家又使用特殊的测量仪器观测到这6个原子中有4个发生了双质子衰变,即由一个原子核同时放出两个质子的衰变方式.下列关于4526Fe的说法正确的是( )
| A、该原子的中子数与质子数之差为3 |
| B、他们获得了一种新元素 |
| C、4526Fe与5626Fe化学性质相同 |
| D、这种铁原子衰变放出两个质子后变成4524Fe |
环境污染以成为人类社会面临的重大威胁,各种污染数不胜数.下列名词与环境污染有关的是( )
①赤潮 ②潮汐 ③水华 ④大脖子病 ⑤水俣病 ⑥酸雨 ⑦臭氧空洞 ⑧光化学污染.
①赤潮 ②潮汐 ③水华 ④大脖子病 ⑤水俣病 ⑥酸雨 ⑦臭氧空洞 ⑧光化学污染.
| A、①④ | B、②③ |
| C、①⑥⑦ | D、②⑦⑧ |
下列家庭垃圾中适合于用堆肥法处理的是( )
| A、旧书纸 | B、旧衣服 |
| C、塑料瓶 | D、熟菜叶 |
对于反应:2Na2O2+2H2O═4NaOH+O2↑,下列说法中正确的是( )
| A、Na2O2是氧化剂,H2O是还原剂 |
| B、该反应中电子转移的数目为4e- |
| C、Na2O2既是氧化剂,又是还原剂 |
| D、O2既是氧化产物,又是还原产物 |
 能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题.
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题.