题目内容
【题目】(1)已知:![]() 石墨
石墨![]()
![]()
![]() 石墨
石墨![]()
则4Fe![]() ______
______
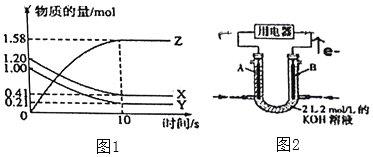
(2)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图1所示:用Z表示的反应速率为______![]() ,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。
,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。
(3)图2为乙烷![]() 燃料电池的装置
燃料电池的装置![]() 、B为多孔碳棒
、B为多孔碳棒![]() :______
:______![]() 填A或
填A或![]() 处电极入口通乙烷,其电极反应式为______。
处电极入口通乙烷,其电极反应式为______。
(4)用中和滴定法测定溶液碱溶液的浓度。
①滴定时,用![]() 的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
②下列操作![]() 其他操作正确
其他操作正确![]() 造成测定结果偏低是______
造成测定结果偏低是______
A.滴定终点读数时俯视读数
B.酸式滴定管使用前水洗后未用标准盐酸溶液润洗
C.锥形瓶水洗用待测液润洗
D.酸式滴定管尖嘴部分有气泡,滴定后消失
【答案】![]()
![]()
![]()
![]()
![]()
![]() 当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色 A
当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色 A
【解析】
(1)Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol①,CO(g)+![]() O2(g)=CO2(g)△H2=-283.0kJ/mol②,C(石墨)+O2(g)=CO2(g)△H3=-393.5kJ/mol③,将方程式6(③-②)-2①得4Fe(s)+3O2(g)=2Fe2O3(s)△H进行相应的改变;
O2(g)=CO2(g)△H2=-283.0kJ/mol②,C(石墨)+O2(g)=CO2(g)△H3=-393.5kJ/mol③,将方程式6(③-②)-2①得4Fe(s)+3O2(g)=2Fe2O3(s)△H进行相应的改变;
(2)用Z表示的反应速率=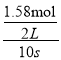 ;根据图知,X、Y是反应物,Z是生成物,达到平衡状态时△n(X)=(1.20-0.41)mol/L=0.79mol、△n(Y)=(1.00-0.21)mol/L=0.79mol、△n(Z)=(1.58-0)mol/L=1.58mol,同一时间段内各物质的物质的量变化量之比等于其计量数之比,则X、Y、Z的计量数之比=0.79mol:0.79mol:1.58mol=1:1:2;
;根据图知,X、Y是反应物,Z是生成物,达到平衡状态时△n(X)=(1.20-0.41)mol/L=0.79mol、△n(Y)=(1.00-0.21)mol/L=0.79mol、△n(Z)=(1.58-0)mol/L=1.58mol,同一时间段内各物质的物质的量变化量之比等于其计量数之比,则X、Y、Z的计量数之比=0.79mol:0.79mol:1.58mol=1:1:2;
又反应开始到10s时,Y的转化率= ×100%;
×100%;
(3)该燃料电池中,通入燃料的电极是负极、通入氧气的电极为正极,外电路中电子从负极沿导线流向正极,根据电子流向知,B是负极、A是正极,负极上乙烷失电子和氢氧根离子反应生成碳酸根离子和水;
(4)①滴定时,用0.2000mol/L的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是 当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色;
②A.滴定终点读数时俯视读数,导致溶液体积偏小;
B.酸式滴定管使用前水洗后未用标准盐酸溶液润洗,导致盐酸浓度偏低,使用盐酸体积偏大;
C.锥形瓶水洗用待测液润洗,导致使用盐酸体积偏大;
D.酸式滴定管尖嘴部分有气泡,滴定后消失,导致盐酸体积偏大。
(1)Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol①,CO(g)+![]() O2(g)=CO2(g)△H2=-283.0kJ/mol②,C(石墨)+O2(g)=CO2(g)△H3=-393.5kJ/mol③,将方程式6(③-②)-2①得4Fe(s)+3O2(g)=2Fe2O3(s)△H=[6(-393.5+283.0)-2(+489)]kJ/mol=-1641.0kJmol-1;
O2(g)=CO2(g)△H2=-283.0kJ/mol②,C(石墨)+O2(g)=CO2(g)△H3=-393.5kJ/mol③,将方程式6(③-②)-2①得4Fe(s)+3O2(g)=2Fe2O3(s)△H=[6(-393.5+283.0)-2(+489)]kJ/mol=-1641.0kJmol-1;
(2)用Z表示的反应速率=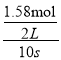 =0.079mol/(Ls);根据图知,X、Y是反应物,Z是生成物,达到平衡状态时△n(X)=(1.20-0.41)mol/L=0.79mol、△n(Y)=(1.00-0.21)mol/L=0.79mol、△n(Z)=(1.58-0)mol/L=1.58mol,同一时间段内各物质的物质的量变化量之比等于其计量数之比,则X、Y、Z的计量数之比=0.79mol:0.79mol:1.58mol=1:1:2,该反应方程式为X+Y2Z;又反应开始到10s时,Y的转化率=
=0.079mol/(Ls);根据图知,X、Y是反应物,Z是生成物,达到平衡状态时△n(X)=(1.20-0.41)mol/L=0.79mol、△n(Y)=(1.00-0.21)mol/L=0.79mol、△n(Z)=(1.58-0)mol/L=1.58mol,同一时间段内各物质的物质的量变化量之比等于其计量数之比,则X、Y、Z的计量数之比=0.79mol:0.79mol:1.58mol=1:1:2,该反应方程式为X+Y2Z;又反应开始到10s时,Y的转化率= ×100%=
×100%=![]() ×100%=79%;
×100%=79%;
(3)该燃料电池中,通入燃料的电极是负极、通入氧气的电极为正极,外电路中电子从负极沿导线流向正极,根据电子流向知,B是负极、A是正极,则B电极通入乙烷,负极上乙烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O;
(4)①滴定时,用0.2000mol/L的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是 当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色;
②A.滴定终点读数时俯视读数,导致溶液体积偏小,测定溶液浓度偏低,故A正确;
B.酸式滴定管使用前水洗后未用标准盐酸溶液润洗,导致盐酸浓度偏低,使用盐酸体积偏大,测定溶液浓度偏高,故B错误;
C.锥形瓶水洗用待测液润洗,导致使用盐酸体积偏大,测定溶液浓度偏高,故C错误;
D.酸式滴定管尖嘴部分有气泡,滴定后消失,导致盐酸体积偏大,测定溶液浓度偏高,故D错误;
故答案为A。

 阅读快车系列答案
阅读快车系列答案