题目内容
17.已知在25℃、1.013×105Pa下,1mol CH4充分燃烧(C转化为CO2气体,H转化为液态水)放出的热量为890kJ,使1kg水的温度升高1℃需热量4.18kJ.(1)1m3(标准状况)甲烷在25℃、1.013×105Pa条件下充分燃烧(生成CO2气体和液态水),释放出的热能是多少?
(2)若用1m3(标准状况)甲烷在25℃、1.013×105Pa条件下充分燃烧所释放的热能加热温度为25℃的水,若热量损失为20%,可使多少千克水沸腾?
分析 (1)根据标况下Vm=22.4L/mol,计算1m3的甲烷的物质的量,再利用物质的量与热量的正比例关系来计算;
(2)根据能量守恒及Q=cm△T来计算.
解答 解:(1)标况下Vm=22.4L/mol,则1m3的甲烷的物质的量$\frac{1000L}{22.4L/mol}$=44.64mol,由25℃,一个标压下,1molCH4充分燃烧放出的热量为890kJ,则1m3(标况)甲烷在25℃,一个标压下充分燃烧,可以放出的热能是44.64×890KJ=39729.6kJ,
答:释放出39729.6KJ的热量;
(2)设水的质量为x,则由Q=cm△T可知,
4.2×x×(100-25)=39729.6KJ×(1-20%),
解得x=101Kg,
答:使101千克水的温度升为100℃.
点评 本题考查反应放出的热量及利用Q=cm△T进行简单计算,熟悉计算公式是解答的关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
5.氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质.下列结论正确的是( )
| A. | 加入有色布条,片刻后有色布条褪色,说明有Cl2存在 | |
| B. | 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在 | |
| C. | 先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在 |
12.下列说法中正确的是( )
| A. | 能发生银镜反应的物质不一定是醛 | |
| B. | 酯在碱性条件下的水解生成相应的羧酸和醇 | |
| C. | 参与酯化反应的物质一定有两种 | |
| D. | 苯酚中羟基对苯环的影响是使苯环上氢原子都变的很活泼 |
2.用水稀释0.1mol•L-1氨水时,溶液中随水量的增加而减小的是( )
| A. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(OH)}$ | C. | n(OH-)和c(H+) | D. | c(H+)和c(OH-)的乘积 |
9.C2H6+Cl2$\stackrel{光照}{→}$C2H5Cl+HCl的反应类型为( )
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 消去反应 |
6.在温度t℃下,某Ba(OH)2的稀溶液中?c(H+)=10-amol.L-1,c(OH-)=10-b mol.L-1,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,t℃大于25℃(填”大于”“小于”或”等于”),该温度下水的离子积KW=1×10-12.
(2)b=4,原Ba(OH)2的稀溶液的物质的量浓度为?5×10-5mol/L?.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为4,以及其中Na2SO4的物质的量浓度为1×10-4mol/L.
| 序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(2)b=4,原Ba(OH)2的稀溶液的物质的量浓度为?5×10-5mol/L?.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为4,以及其中Na2SO4的物质的量浓度为1×10-4mol/L.
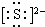 K+,⑤的结构式是O=C=O.
K+,⑤的结构式是O=C=O. 选择适宜的材料和试剂设计一个原电池,完成下列反应:
选择适宜的材料和试剂设计一个原电池,完成下列反应: